
科目: 来源: 题型:实验题
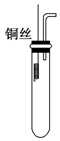 铜与浓硝酸反应和铜与稀硝酸反应的产物不同,实验现象也不同.
铜与浓硝酸反应和铜与稀硝酸反应的产物不同,实验现象也不同.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 质量相等的O2和O3 | B. | 原子数目相等的CO和N2 | ||
| C. | 电子数目相等的O2和N2 | D. | 等压、等体积的N2和CH4 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 石灰石溶于稀盐酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | 硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| C. | 氧化镁与稀硫酸:MgO+2H+═Mg2++H2O | |
| D. | 常温下,将铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 稀释浓硫酸时,将水沿器壁慢慢注入酸中 | |
| B. | 点燃氢气前,先检验氢气的纯度 | |
| C. | 加热液体时,试管口不对着人 | |
| D. | 利用丁达尔效应区别胶体和溶液 |
查看答案和解析>>
科目: 来源: 题型:选择题
 脑白金又名褪黑激素,据报道它几有提高免疫力.促进睡眠等功能.其结构简式为:下列有关脑白金说法不正确的是( )
脑白金又名褪黑激素,据报道它几有提高免疫力.促进睡眠等功能.其结构简式为:下列有关脑白金说法不正确的是( )| A. | 能发生加成反应 | B. | 属于芳香族化合物 | ||
| C. | 分子式为C13H16N2O2 | D. | 不能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验序号 | 温度℃ | 初始CCl4浓度mol/L | 初始H2浓度mol/L | CCl4的平衡转化率 |
| 1 | 110 | 0.8 | 1.2 | A |
| 2 | 110 | 1 | 1 | 50% |
| 3 | 120 | 1 | 1 | B |
查看答案和解析>>
科目: 来源: 题型:推断题
 乙烯是石油化工的重要产品,以乙烯为原料制备一些化工产品的流程如图:
乙烯是石油化工的重要产品,以乙烯为原料制备一些化工产品的流程如图: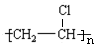
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.1mol•L-1 的KI溶液中:MnO4-、Na+、Cl-、OH- | |
| B. | 0.1mol•L-1 的NH3•H2O 溶液中Fe3+、Na+、SO42-、ClO- | |
| C. | 遇石蕊试液变红的溶液中:Na+、Mg2+、Cl-、SO42- | |
| D. | 遇酚酞变红的溶液中:K+、S2O32-、NO3-、H+ |
查看答案和解析>>
科目: 来源: 题型:实验题
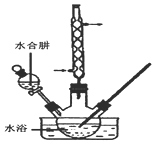 碘化钠是一种白色结晶粉末,医疗上可用于甲状腺肿瘤防治剂、祛痰剂等.实验室用NaOH、单质碘和水合肼为原料制得,部分装置如图所示.
碘化钠是一种白色结晶粉末,医疗上可用于甲状腺肿瘤防治剂、祛痰剂等.实验室用NaOH、单质碘和水合肼为原料制得,部分装置如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com