
科目: 来源: 题型:解答题
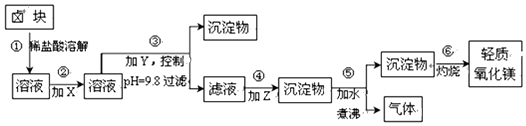
| 表1:生成氢氧化物沉淀的pH | 表2:原料价格表 | |||
| 物质 | 开始沉淀 | 沉淀完全 | 物质 | 价格(元/吨) |
| Fe(OH)3 | 2.7 | 3.7 | a.漂液(含25.2%NaClO) | 450 |
| Fe(OH)2 | 7.6 | 9.6 | b.双氧水(含30%H2O2) | 1500 |
| Mn(OH)2 | 8.3 | 9.8 | c.烧碱(含98%NaOH) | 2200 |
| Mg(OH)2 | 9.6 | 11.1 | d.纯碱(含99.5%Na2CO) | 800 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 混合气体中含有的碳碳双键数为NA | |
| B. | 混合气体中含有的碳原子数为2NA | |
| C. | 当混合气体完全燃烧时,消耗O2的分子数为3NA | |
| D. | 当混合气体完全燃烧时,转移的电子数为12NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 密度比空气小 | |
| B. | 是无色无味的气体 | |
| C. | SO2能使溴水褪色,说明SO2具有漂白性 | |
| D. | 某生产硫酸厂区紫罗兰花变成白色,说明其周围空气中可能含较高浓度SO2 |
查看答案和解析>>
科目: 来源: 题型:解答题
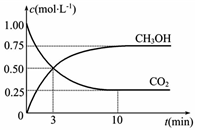 “低碳循环”引起各国的高度重视,已知煤、甲烷等可以与水蒸气反应生成以CO和H2为主的合成气,合成气有广泛应用.试回答下列问题:
“低碳循环”引起各国的高度重视,已知煤、甲烷等可以与水蒸气反应生成以CO和H2为主的合成气,合成气有广泛应用.试回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 8g CH4O中含有的C-H键数目为NA | |
| B. | 25℃时,100mL pH=8的氨水中NH4+的个数为9.9×10-8NA | |
| C. | 56g Fe和64g Cu分别与1 mol S反应转移的电子数均为2NA | |
| D. | 标准状况下,2.24 LCl2溶于水所得氯水中含氯的微粒总数为0.2NA |
查看答案和解析>>
科目: 来源: 题型:解答题
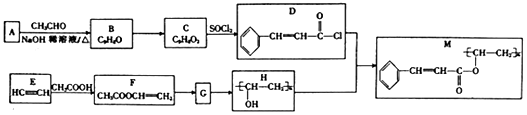
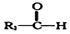 +
+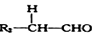 $→_{△}^{NaOH稀溶液}$
$→_{△}^{NaOH稀溶液}$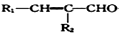 +H2O(R1、R2为羟基或氯)
+H2O(R1、R2为羟基或氯) .
.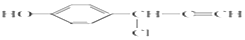 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 配合物中中心原子的电荷数和配位数均为6 | |
| B. | Pt4+提供孤对电子 | |
| C. | Cl-和NH3分子均与Pt4+配位 | |
| D. | 配合物中Cl-与Pt4+配位,而NH3分子不配位 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | HCN的结构式:H-C≡N | |
| B. | HClO的电子式: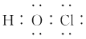 | |
| C. | 质子数为86、中子数为51的铯原子:86137Cs | |
| D. | S2-的结构示意图: |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NH4+、K+、CO32-、Cl- | B. | Al3+、Cu2+、S2-、Cl- | ||
| C. | NH4+、Cu2+、Cl-、NO3- | D. | Fe3+、K+、SCN-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com