
科目: 来源: 题型:选择题
| 选项 | 纯净物 | 盐 | 碱性氧化物 | 酸性氧化物 |
| A | 碱石灰 | 烧碱 | 氧化铝 | 二氧化碳 |
| B | NH3•H2O | 小苏打 | 氧化镁 | 二氧化氮 |
| C | 五水硫酸铜 | 纯碱 | 氧化钠 | 三氧化硫 |
| D | H2O2 | 苏打 | 过氧化钠 | 二氧化硫 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温常压下,11.2 L氧气所含的分子数为NA | |
| B. | 1.8 g 的NH4+中含有的电子数为1.1NA | |
| C. | 22g二氧化碳与标准状况下11.2LH2含有相同的原子数 | |
| D. | 2.3 g金属钠与O2完全反应,转移电子的物质的量为0.1mol |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | C5H10O2 | B. | C5H10O5 | C. | C6H6O | D. | C6H12O6 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 呈弱酸性,使石蕊试液显浅红色 | |
| B. | 分子中的13个原子有可能处于同一平面 | |
| C. | 可以和NaHCO3溶液反应产生气体 | |
| D. | 能与FeCl3溶液反应生成紫色沉淀 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
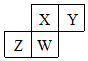 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法错误的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法错误的是( )| A. | 原子半径:Z>W>X>Y | |
| B. | 元素X、Z的最高化合价分别与其主族序数相等 | |
| C. | 最高价氧化物对应水化物的酸性:Y>X>W | |
| D. | 最简单气态氢化物的热稳定性:Y>X>W>Z |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 羰基硫与烧碱溶液反应生成水和两种正盐的离子方程式为COS+4NaOH=Na2S+Na2CO3+2H2O羰基硫的脱硫常用两种方法,其反应式分别为:
羰基硫与烧碱溶液反应生成水和两种正盐的离子方程式为COS+4NaOH=Na2S+Na2CO3+2H2O羰基硫的脱硫常用两种方法,其反应式分别为:| 化学键 | C=O(CO2) | C=O(COS) | C=S | H-S | H-O |
| 键能(kJ/mol) | 803 | 742 | 577 | 339 | 465 |
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | mmolCO2、3mmolH2、 nmolCH3OH(g)、nmolH2O(g) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com