
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
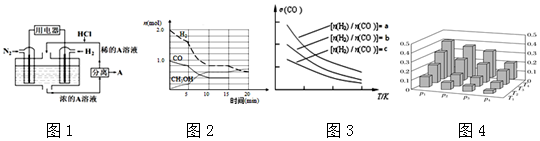
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 简单离子半径:Z<Y<X<W | |
| B. | 气态简单氢化物的稳定性:Y<X | |
| C. | Q和M中的阴、阳离子个数比均为1:2,但化学键种类有差异 | |
| D. | Z与W能形成ZW或Z2W型离子化合物 |
查看答案和解析>>
科目: 来源: 题型:推断题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:实验题
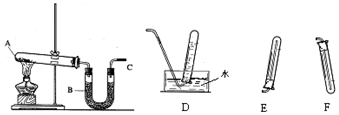
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ②④⑥ | B. | ①③⑤ | C. | ③④⑥ | D. | ①②⑤ |
查看答案和解析>>
科目: 来源: 题型:实验题
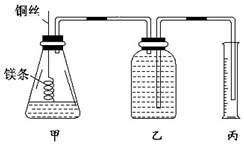 某研究性学习小组欲测定室温下(25℃、101 kPa)的气体摩尔体积,请回答以下问题.该小组设计的简易实验装置如图所示:
某研究性学习小组欲测定室温下(25℃、101 kPa)的气体摩尔体积,请回答以下问题.该小组设计的简易实验装置如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com