
科目: 来源: 题型:实验题
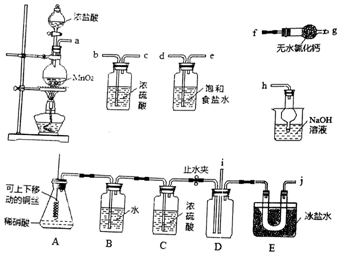
查看答案和解析>>
科目: 来源: 题型:解答题
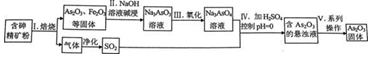
查看答案和解析>>
科目: 来源: 题型:选择题
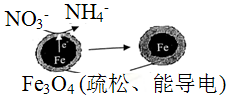
| A. | 能量转化形式主要为化学能转化为电能 | |
| B. | 电极材料分别为Fe和Fe3O4 | |
| C. | 负极反应为:NO3-+8e-+l0H+═NH4++3H2O | |
| D. | 该原理的总反应可表示为:NO3-+3Fe+2H++H2O═NH4++Fe3O4 |
查看答案和解析>>
科目: 来源: 题型:选择题
| W | X | |
| Z |
| A. | 非金属性:W<Z | B. | 简单离子的半径:X2-<Y2+ | ||
| C. | 沸点:H2X<H2Z | D. | WX2的电子式为: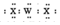 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 丙烯酸使溴水褪色属于氧化反应 | |
| B. | 丙烯酸能发生加成反应但不能发生取代反应 | |
| C. | 丙烯酸分子中所有碳原子不可能处于同一平面 | |
| D. | 反应CH2=CHCOOH+H2$→_{△}^{Ni}$CH3CH2COOH的原子利用率为100% |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na2O2可用作供氧剂 | |
| B. | Al2O3可用作耐火材料 | |
| C. | 地沟油经处理后可用作燃料油 | |
| D. | 胶体和溶液的本质区别是胶体具有丁达尔现象 |
查看答案和解析>>
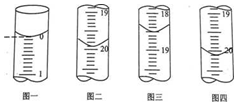
科目: 来源: 题型:选择题

| A. | 已知298K时氢氰酸(HCN)的Ka=4.9×10-10,碳酸的Ka1=4.4×10-7,Ka2=4.7×10-11,据此可推测将氢氰酸加入到碳酸钠溶液中不可能观察到有气泡产生 | |
| B. | 25℃时,将amol•L氨水与0.01mol•L-1盐酸等体积混合,反应完全时溶液中c(NH4+)=c(CI-),用含a的代数式表示NH3•H2O的电离常数Kb=$\frac{1{0}^{-9}}{a-0.01}$ | |
| C. | 某温度下,相同体积、相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积V变化的曲线如图所示.II为醋酸稀释时pH的变化曲线,且a、b两点水的电离程度:a<b | |
| D. | 向0.10mol•L-1NaHSO4溶液中通入NH3至溶液pH=7(通入气体对溶液体积的影响可忽略):c(Na+)>c(SO42-)>c(NH4+) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 海水$\stackrel{石灰乳}{→}$Mg(OH)2$\stackrel{灼烧}{→}$MgO$\stackrel{电解}{→}$Mg | |
| B. | 由NaCl制漂白剂:NaCl(aq)$\stackrel{电解}{→}$Cl2$\stackrel{石灰乳}{→}$漂白粉 | |
| C. | 由铝土矿冶炼铝:铝土矿$→_{Na_{3}AlF_{6}}^{电解}$Al | |
| D. | 合成NH3:NH4Cl和Ca(OH)2固体$\stackrel{△}{→}$NH3$\stackrel{碱石灰}{→}$纯净干燥的氨气 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 分子式为C5H12O的有机物,分子中含有2个甲基的同分异构体有4种 | |
| B. | 乙烷、苯、氯乙烯等三种有机化合物分子内所有原子均在同一平面上 | |
| C. | 由乙酸和乙醇制乙酸乙酯的反应及油脂的水解反应均属于取代反应 | |
| D. | 乙烯和苯都能使溴水褪色,且褪色的原理相同 |
查看答案和解析>>
科目: 来源: 题型:选择题
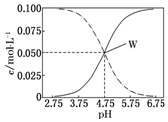 常温下,醋酸、醋酸钠混合溶液中,已知c(CH3COOH)+c(CH3COO-)=0.1mol•L-1,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列有关溶液中离子浓度关系的说法正确的是( )
常温下,醋酸、醋酸钠混合溶液中,已知c(CH3COOH)+c(CH3COO-)=0.1mol•L-1,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列有关溶液中离子浓度关系的说法正确的是( )| A. | pH=5.75的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | pH=7,c(Na+)=0.1 mol•L-1,c( CH3COOH)>c(Na+)=c( CH3COO-)>c(H+)=c(OH-) | |
| C. | pH=3.5的溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1 mol•L-1 | |
| D. | 向W点所表示的1.0 L溶液中通入0.05 mol HCl气体(溶液体积变化可忽略):c(H+)=c(CH3COOH)+c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com