
科目: 来源: 题型:选择题
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | Ki=1.77×10-4 | Ki=4.9×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
| A. | 2CN-+H2O+CO2=2HCN+CO32- | |
| B. | 2HCOOH+CO32-=2HCOO-+H2O+CO2↑ | |
| C. | 中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者 | |
| D. | 等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者小于后者 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 甲的分子数比乙的分子数多 | |
| B. | 甲的摩尔体积比乙的摩尔体积小 | |
| C. | 甲的相对分子质量比乙的相对分子质量大 | |
| D. | 甲的物质的量比乙的物质的量少 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 含有0.2mol K2SO4 | |
| B. | K+的物质的量浓度为0.2mol•L-1 | |
| C. | K的物质的量为0.8mol | |
| D. | 取出1LK2SO4溶液后,剩余K2SO4溶液的浓度变为0.1mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CuCl2具有一定的氧化性 | |
| B. | 电解CuCl2水溶液时,阳极一定得到Cu单质 | |
| C. | Cu(OH)2•CuCl2 属于碱式盐 | |
| D. | 制备无水CuCl2时,需要在HCl气流中加热脱水 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原子半径:Y<Z<W | |
| B. | 单质的还原性:Y<Z | |
| C. | 简单气态氢化物的稳定性:X>W | |
| D. | Y和Z两者最高价氧化物对应的水化物不能相互反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 溶质的质量分数是12.5% | |
| B. | 溶液的物质的量浓度是5d/16mol/L | |
| C. | Fe3+的物质的量浓度是5d/8mol/L | |
| D. | 硫酸根离子的物质的量浓度是10d/16mol/L |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,1L C2H5OH完全燃烧后生成的CO2分子个数约为$\frac{{N}_{A}}{11.2}$ | |
| B. | 通入了1molCl2的新制氯水中,HC1O、Cl一、C1O-粒子数之和为2NA | |
| C. | 含3.0g HCHO的水溶液中原子总数为0.4NA | |
| D. | 3.4gNH3中共用电子对数为0.6NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | n(CO2)/mol | 溶液中离子的物质的量浓度 |
| A | 0 | c(Na+)>c(AlO2-)>c(OH-)>c(H+) |
| B | 0.1 | c(Na+)>c(AlO2-)>c(CO32-)>c(OH-)>c(H+) |
| C | 0.2 | c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) |
| D | 0.3 | c(Na+)>c(HCO3-)>c(OH-)>c(H+) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:实验题
| 操作 | 现象 |
| 取4g 漂粉精固体,加入100mL 水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH 试纸先变蓝(约为12),后褪色 |
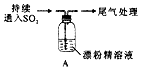 | 1.液面上方出现白雾; 2.稍后,出现浑浊,溶液变为黄绿色; 3.稍后,产生大量白色沉淀,黄绿色褪去 |
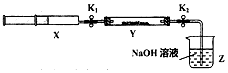
| 操作步骤 | 实验现象 | 解释原因 |
| 打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中(假设充分反应) | (1)淡黄色固体变为白色粉末 | (2)反应的化学方程式:SO2+Na2O2=Na2SO4 |
| 将注射器活塞退回原处并固定,待装置恢复到室温,打开K2 | (3)Z中NaOH溶液倒吸入Y管中 | (4)不用解释 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com