
科目: 来源: 题型:选择题

| A. | 图1表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| B. | 图2表示常温下,等量锌粉与足量的等浓度的盐酸反应(滴加CuSO4溶液的为虚线) | |
| C. | 图3表示KNO3的溶解度曲线,a点所示的溶液是80℃时KNO3的不饱和溶液 | |
| D. | 图4表示水溶液中c(H+)和c(OH )的关系,在水中通适量KCl气体可从a点变到c点 |
查看答案和解析>>
科目: 来源: 题型:解答题
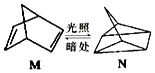 含碳的化合物之间很容易发生转化.请回答下列问题:
含碳的化合物之间很容易发生转化.请回答下列问题: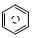 (l)的燃烧热为 3267.5kJ•mol-1,
(l)的燃烧热为 3267.5kJ•mol-1,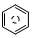 (l)+6O 2(g)═6CO2 (g)+3H2 (g)
(l)+6O 2(g)═6CO2 (g)+3H2 (g)查看答案和解析>>
科目: 来源: 题型:解答题
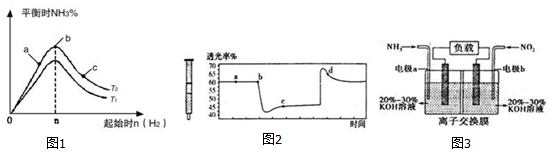
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 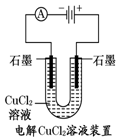 装置中阳极上析出红色固体 | |
| B. | 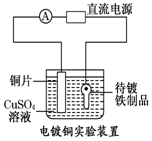 装置的待镀铁制品应与电源正极相连 | |
| C. | 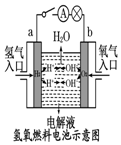 装置中外电路电子由a极流向b极 | |
| D. | 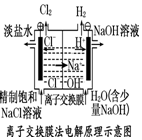 装置的阳极反应为:2H++2e-=H2↑ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 明矾净水的原理和家用消毒液消毒的原理相同,都能起到消毒杀菌作用 | |
| B. | 聚乙烯、聚氯乙烯都是高分子化合物,但聚氯乙烯薄膜不能用于包装食品 | |
| C. | “天宫一号”使用的碳纤维,是一种新型有机高分子材料 | |
| D. | 铝合金的大量使用,归功于人们能用焦炭等还原剂从氧化铝中获得铝 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 三处 | B. | 四处 | C. | 五处 | D. | 六处 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 16gO2与16gO3体积比为3:2 | |
| B. | 由H2、O2组成的混合气,密度是氢气的8.5倍,混合气中H2的质量分数为50% | |
| C. | 将标况下22.4L的HCl气体溶于1 L水中配制1mol/L的HCl溶液 | |
| D. | 1mL 3mol/L的K2SO4溶液和100mL 1mol/L的Al2(SO4)3溶液,SO42-浓度相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com