
科目: 来源: 题型:选择题
| A. | Y、Z着火时均可用泡沫灭火器进行灭火 | |
| B. | 最高价氧化物对应水化物的碱性:Y>Z | |
| C. | Y、Z、W的简单离子都能促进水的电离 | |
| D. | 原子半径由小到大的顺序:X<W<Z<Y |
查看答案和解析>>
科目: 来源: 题型:解答题
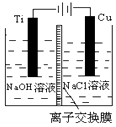 纳米级Cu2O由于具有优良的催化性能而备受关注,下表为制取纳米级Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而备受关注,下表为制取纳米级Cu2O的三种方法:
查看答案和解析>>
科目: 来源: 题型:选择题
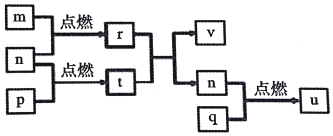 短周期主族元素X、Y、Z、W的原子序数依次增大.四种元素形成的单质依次为m、n、p、q,r、t、u是这些元素组成的二元化合物,其中u为形成酸雨的主要物质之一;25℃时,0.01mol•L-1的v溶液中:$\frac{c(O{H}^{-})}{c({H}^{+})}$=1.0×1010.上述物质的转化关系如图所示.下列说法正确的是( )
短周期主族元素X、Y、Z、W的原子序数依次增大.四种元素形成的单质依次为m、n、p、q,r、t、u是这些元素组成的二元化合物,其中u为形成酸雨的主要物质之一;25℃时,0.01mol•L-1的v溶液中:$\frac{c(O{H}^{-})}{c({H}^{+})}$=1.0×1010.上述物质的转化关系如图所示.下列说法正确的是( )| A. | 原子半径的大小:W>Z>Y>X | |
| B. | Z分别与Y、W组成的化合物中化学键类型可能相同 | |
| C. | v能抑制水的电离而u能促进水的电离 | |
| D. | 粘有q的试管可用酒精洗涤 |
查看答案和解析>>
科目: 来源: 题型:解答题
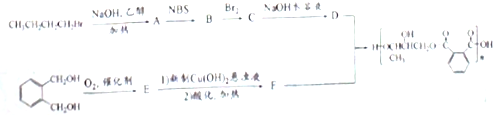

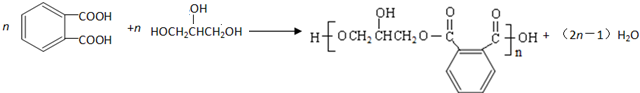
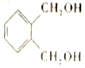 的符合下列条件的同分异构体有6 种(不考虑立体异构)
的符合下列条件的同分异构体有6 种(不考虑立体异构)查看答案和解析>>
科目: 来源: 题型:选择题
 在25℃下,稀释HA、HB两种酸溶液,溶液pH变化的曲线如图所示,其中V1表示稀释前酸的体积,V2表示稀释后溶液的体积.下列说法正确的是( )
在25℃下,稀释HA、HB两种酸溶液,溶液pH变化的曲线如图所示,其中V1表示稀释前酸的体积,V2表示稀释后溶液的体积.下列说法正确的是( )| A. | lg$\frac{{V}_{2}}{{V}_{1}}$=6时,HA溶液的pH=8 | |
| B. | pH相同时,c(HA)>c(HB) | |
| C. | 曲线上a、b两点 $\frac{[{B}^{-}]}{[HB][O{H}^{-}]}$ 一定不相等 | |
| D. | 25℃时,NaA溶液的pH一定小于NaB溶液 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 用pH试纸测定等浓度的HCl、H2SO4两溶液的pH | 测定HCl溶液的pH试纸更红 | 非金属性Cl>S |
| B | 将AgCl和AgBr的饱和溶液等体积混合 | 出现淡黄色沉淀 | Ksp(AgBr)<Ksp(AgCl) |
| C | 向Al2(SO4)3溶液中滴加过量氢氧化钡溶液 | 生成白色沉淀 | A l(OH)3 不溶于氢氧化钡溶液 |
| D | 将Fe(NO3)2 样品溶于稀硫酸,滴加KSCN溶液 | 溶液变红 | Fe(NO3)3 样品溶于稀硫酸前已氧化变质 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:实验题
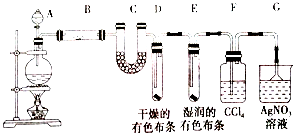
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na+、Mg2+、Cl-、SO42- | B. | Na+、Ca2+、CO32-、NO3- | ||
| C. | Na+、H+、Cl-、CO32- | D. | K+、Al3+、SO42-、OH- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 第ⅠA族元素都是典型的金属元素 | |
| B. | 过渡元素都是金属元素 | |
| C. | 任何元素的原子都是由核外电子和核内质子、中子所组成 | |
| D. | 均属“镧系元素”的镧(57La)与铈(58Ce)互为同位素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com