
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
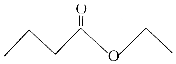 茅台酒中存在少量具有凤梨香味的物质X,其结构如图所示,下列说法正确的是( )
茅台酒中存在少量具有凤梨香味的物质X,其结构如图所示,下列说法正确的是( )| A. | X难溶于乙醇 | |
| B. | X的分子式为C6H10O2 | |
| C. | 酒中的少量丁酸能抑制X的水解 | |
| D. | 分子式为C4H8O2且官能团与X相同的物质共有5种(不考虑立体结构) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 6.2g白磷中所含P-P键的数目为0.15NA | |
| B. | 含H2O2 3.4克的溶液完全分解,其电子转移数目为NA | |
| C. | 117g氯化钠固体含有2NA个氯化钠分子 | |
| D. | 6克金刚石含NA个C-C键 |
查看答案和解析>>
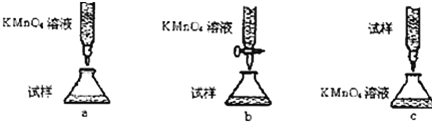
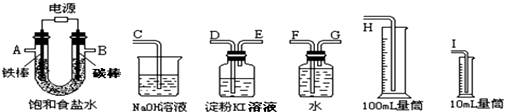
科目: 来源: 题型:实验题
 如图所示,将仪器A中的浓盐酸滴加到盛有MnO2的烧瓶中,加热后产生的气体依次通过装置B和C,然后再通过加热的石英玻璃管D(放置有铁粉).请回答:
如图所示,将仪器A中的浓盐酸滴加到盛有MnO2的烧瓶中,加热后产生的气体依次通过装置B和C,然后再通过加热的石英玻璃管D(放置有铁粉).请回答:查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
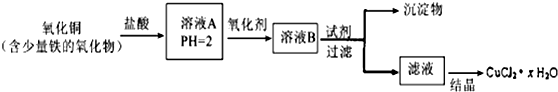
科目: 来源: 题型:解答题
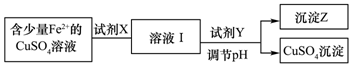
| 金属 离子 | pH | |
| 开始沉淀 | 完全沉淀 | |
| Fe2+ | 7.6 | 9.6 |
| Cu2+ | 4.4 | 6.4 |
| Fe3+ | 2.7 | 3.7 |
查看答案和解析>>
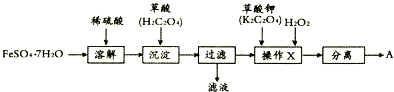
科目: 来源: 题型:解答题
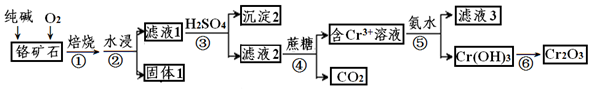
查看答案和解析>>
科目: 来源: 题型:实验题
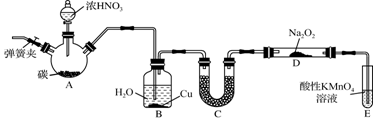
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com