
科目: 来源: 题型:多选题
| A. | 0.6 | B. | 0.9 | C. | 1.6 | D. | 1.7 |
查看答案和解析>>
科目: 来源: 题型:选择题
| X | Y | W | Q | |
| 10min | 1.0mol | 3.0mol | 1.0mol | 2.0mol |
| 20min | 0.5mol | 1.5mol | 2.0mol | 1.0mol |
| A. | X+2Y═2W+2Q | B. | 3X+Y+2W═2Q | C. | X+3Y+2Q═2W | D. | X+2Y+3Q═2W |
查看答案和解析>>
科目: 来源: 题型:选择题
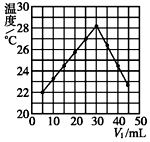 将V1 mL 1.0mol•L-1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50,溶液混前温度为21℃).下列叙述正确的是( )
将V1 mL 1.0mol•L-1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50,溶液混前温度为21℃).下列叙述正确的是( )| A. | 该实验表明所有化学反应化学能只转化为热能 | |
| B. | NaOH溶液的浓度为1.0mol•L-1 | |
| C. | 该实验提供的数据能粗略计算出中和热 | |
| D. | 该实验可分多次把NaOH溶液倒入盛有盐酸的小烧杯中 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验序号 | 起始温度t1/℃ | 终止温度(t2)/℃ | 温差(t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 28.3 | 3.3 |
| 2 | 25.1 | 25.1 | 25.1 | 28.4 | 3.3 |
| 3 | 25.1 | 25.1 | 25.1 | 28.5 | 3.4 |
查看答案和解析>>
科目: 来源: 题型:实验题
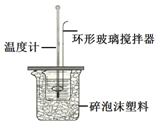 测定稀盐酸和稀氢氧化钠中和热的实验装置如图所示.(中和热:在稀溶液中,酸跟碱发生中和反应生成1mol水时的反应热)
测定稀盐酸和稀氢氧化钠中和热的实验装置如图所示.(中和热:在稀溶液中,酸跟碱发生中和反应生成1mol水时的反应热)| 温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| HCl | NaOH | ||
| 1 | 26.1 | 26.1 | 29.3 |
| 2 | 25.9 | 25.9 | 29.0 |
| 3 | 26.3 | 26.3 | 29.6 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1mol FeI2与足量氯气反应时转移的电子数为2NA | |
| B. | 常温下,56g铁片投入足量浓H2SO4中生成NA个SO2分子 | |
| C. | 1molCl2参加的氧化还原反应,反应过程中转移电子数都是2NA | |
| D. | 常温常压下,92gNO2和N2O4混合气体含有的原子数为6NA |
查看答案和解析>>
科目: 来源: 题型:解答题
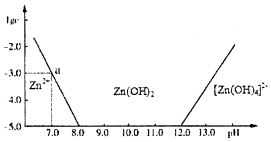 锌和铝都是活泼金属,它们的单质及化合物的性质具有一定的相似性.
锌和铝都是活泼金属,它们的单质及化合物的性质具有一定的相似性.| C(HCl)/(mol•L-1) | 0.50 | 1.00 | 2.04 | 2.90 | 4.02 | 5.16 | 5.78 |
| C(PbCl2)/(mol•L-1)×10-3 | 5.10 | 4.91 | 5.21 | 5.90 | 7.48 | 10.81 | 14.01 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 实验编号 | 温度/℃ | 平衡常数/mol-1•L | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| SO2 | O2 | SO2 | O2 | ||||
| 1 | T1 | K1 | 4 | 2 | x | 0.8 | 6 |
| 2 | T2 | K2 | 4 | 2 | 0.4 | y | t |
| A. | 实验1在前6min的平均反应速率υ(SO2)=0.2 mol•L-1•min-1 | |
| B. | T1、T2的关系:T1>T2 | |
| C. | K1、K2的关系:K2>K1 | |
| D. | x=1.6,y=0.2,t<6 |
查看答案和解析>>
科目: 来源: 题型:填空题
 (填结构简式)
(填结构简式)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com