
科目: 来源: 题型:选择题
| A. | H2的燃烧热为285.8 kJ•mol-1,则表示H2燃烧的热化学方程式可表示为:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-285.8 kJ•mol-1 | |
| B. | 中和热为57.3 kJ•mol-1,则NaOH与醋酸反应的中和热可以表示如下:NaOH(aq)+CH3COOH(aq)═CH3COONa(aq)+H2O(l)△H=-57.3 kJ•mol-1 | |
| C. | 已知:C(s,金刚石)+O2(g)═CO2(g)△H=-395.4 kJ•mol-1,C(s,石墨)+O2(g)═CO2(g)△H=-393.5 kJ•mol-1,则C(s,金刚石)═C(s,石墨)△H=-1.9 kJ•mol-1 | |
| D. | 已知1 mol CH4完全燃烧生成CO2和液态水放出890.4 kJ的热量,则该反应中转移1 mol电子时放出的热量为222.6 kJ |
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:解答题
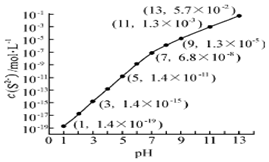 自然界中存在着S元素,它对生物具有重要的作用.
自然界中存在着S元素,它对生物具有重要的作用.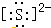 .
.| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-4 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
查看答案和解析>>
科目: 来源: 题型:解答题
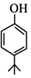 ,同时满足下列条件的X的同分异构体共有26种.(①苯环上有三个取代基 ②能与FeCl3溶液显色)写出其中苯环上只有两种不同化学环境氢原子的两种异构体的结构简式:
,同时满足下列条件的X的同分异构体共有26种.(①苯环上有三个取代基 ②能与FeCl3溶液显色)写出其中苯环上只有两种不同化学环境氢原子的两种异构体的结构简式: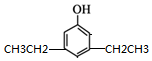 、
、 .
.查看答案和解析>>
科目: 来源: 题型:多选题
| A. | Na与H2O的反应是熵增的放热反应,该反应能自发进行 | |
| B. | 镀锌制品镀层破损后,该铁制品比受损前更容易生锈 | |
| C. | 水中加入少量氯化铁固体,溶液中水的电离平衡会向右移动 | |
| D. | pH=3的盐酸与pH=10的某碱溶液等体积混合溶液呈碱性,说明该碱为强碱 |
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:解答题

| 酸 | HClO2 | H2CO3 | HClO |
| Ka | 1×10-2 | K1=4.3×10-7、K2=5.6×10-11 | 3×10-8 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com