
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
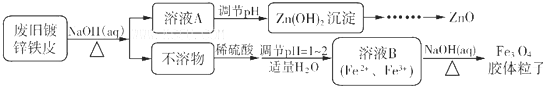
查看答案和解析>>
科目: 来源: 题型:解答题
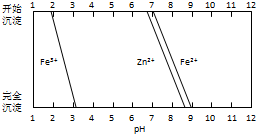 铁酸锌(ZnFe2O4)是对可见光敏感的半导体催化剂,其实验室制备原理为:
铁酸锌(ZnFe2O4)是对可见光敏感的半导体催化剂,其实验室制备原理为:查看答案和解析>>
科目: 来源: 题型:解答题
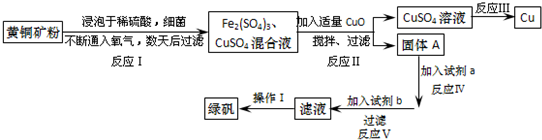
| Fe2+ | Cu2+ | Fe3+ | |
| 开始转化成氢氧化物沉淀时的pH | 7.6 | 4.7 | 2.7 |
| 完全转化成氢氧化物沉淀时的pH | 9.6 | 6.7 | 3.7 |
查看答案和解析>>
科目: 来源: 题型:解答题
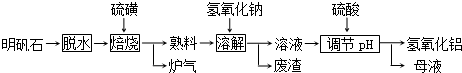
查看答案和解析>>
科目: 来源: 题型:解答题
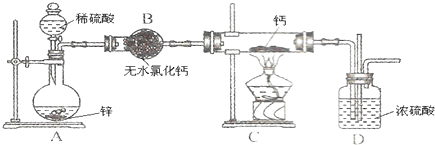
查看答案和解析>>
科目: 来源: 题型:选择题
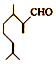 )是一种重要的香料,在硫酸的作用下能生成对异丙基甲苯(
)是一种重要的香料,在硫酸的作用下能生成对异丙基甲苯( ) 下列有关香叶醛与对异丙基甲苯的叙述正确的是( )
) 下列有关香叶醛与对异丙基甲苯的叙述正确的是( )| A. | 两者互为同分异构体 | |
| B. | 两者均能与溴水发生加成反应 | |
| C. | 香叶醛的一种同分异构体可能是芳香醇 | |
| D. | 对异丙基甲苯的分子式为C10H14 |
查看答案和解析>>
科目: 来源: 题型:解答题
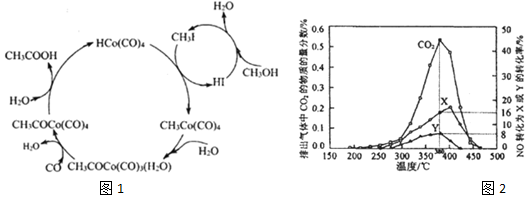
| 模拟尾气 | 气体 | 碳烟 | ||
| NO | O2 | He | ||
| 物质的量分数或物质的量 | 0.25% | 5% | 94.75% | a mol |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 0.1mol•L-1NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| B. | 0.1mol•L-1NaOH溶液中通入SO2气体至pH=7:c(Na+)=c(HSO3-)+2 c(SO32-)+c(H2SO3) | |
| C. | 等物质的量浓度的CH3COOH溶液与NaOH溶液等体积混合后所得pH=9的溶液:c(OH-)-c(CH3COOH)=c(H+)=l×10-9mol•L-1 | |
| D. | 20 mL0.1mol•L-1CH3COONa溶液与10 mL 0.1mol•L-1HCl溶液混合得到的溶液:c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-) |
查看答案和解析>>
科目: 来源: 题型:多选题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向沸水中滴入几滴FeCl3饱和溶液,继续煮沸,并用激光笔照射 | 溶液变红褐色,出现 丁达尔效应 | 产生了 Fe(OH)3胶体 |
| B | 向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液 | 溶液变蓝 | 氧化性:Fe3+>I2 |
| C | 将溴乙烷和NaOH的乙醇溶液混合加热,产生气体通入酸性KMnO4溶液 | 酸性KMnO4溶液褪色 | 产生了乙烯 |
| D | 向滴有酚酞的Na2CO3溶液中,逐滴加入BaCl2溶液 | 溶液红色逐渐褪去 | BaCl2溶液呈酸性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com