
科目: 来源: 题型:选择题
| A. | 常温下,AgCl 在饱和 NaCl 溶液中的 KSP 比在纯水中的 KSP 小 | |
| B. | 向 AgCl 的悬浊液中加入 KI 溶液,沉淀由白色转化为黄色 | |
| C. | 向 AgCl 的饱和溶液中加入 NaCl 晶体,有 AgCl 析出且溶液中 c(Ag+)=c(Cl-) | |
| D. | 将 0.001 mol•L-1 的 AgNO3 溶液滴入 KCl 和 KI 的混合溶液中,一定先产生 AgI 沉淀 |
查看答案和解析>>
科目: 来源: 题型:实验题
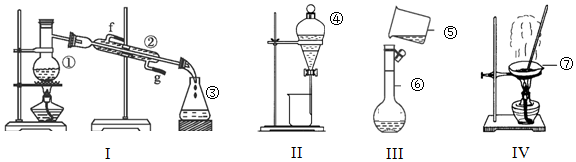
查看答案和解析>>
科目: 来源: 题型:解答题
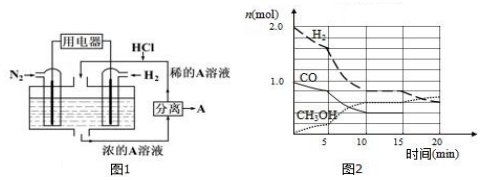
查看答案和解析>>
科目: 来源: 题型:解答题
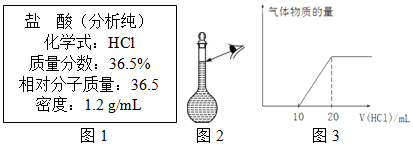
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 食盐、次氯酸钠溶液均可以将某些病毒氧化而达到消毒的目的 | |
| B. | 大力实施矿物燃料“脱硫、脱硝”技术,可减少酸雨的发生 | |
| C. | 光纤通信使用的光缆的主要成分是晶体Si,太阳能电池使用的材枓主要是SiO2 | |
| D. | 节日燃放的烟花,是碱金属、锶、铂、铁等金属化合物焰色反应所呈现的色彩 |
查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:实验题
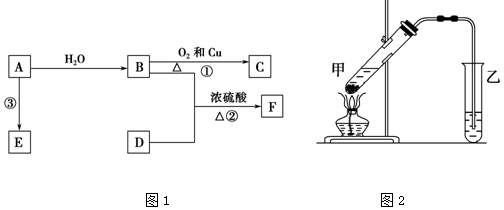
查看答案和解析>>
科目: 来源: 题型:解答题
| 元素 | 部分信息 |
| X | X的单质由双原子分子构成,分子中有14个电子 |
| Y | Y原子的次外层电子数等于最外层电子数的一半 |
| Z | Z元素的最高正化合价与最低负化合价的代数和等于6 |
| W | 地壳中含量最多的金属元素 |
 .
.查看答案和解析>>
科目: 来源: 题型:计算题
 实验室测定常温下l molH2的体积通常用如图所示的装置.
实验室测定常温下l molH2的体积通常用如图所示的装置.| 实验次数 | 镁带质量(g) | 硫酸体积( mL) | 氢气体积( mL) | l摩尔气体的体积(L)(精确到0.001L) |
| 1 | 0.050 | 10 | 49.0 | |
| 2 | 0.049 | 10 | 48.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com