
科目: 来源: 题型:填空题
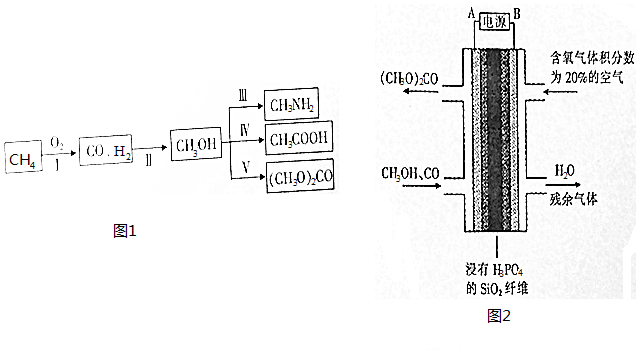
查看答案和解析>>
科目: 来源: 题型:选择题
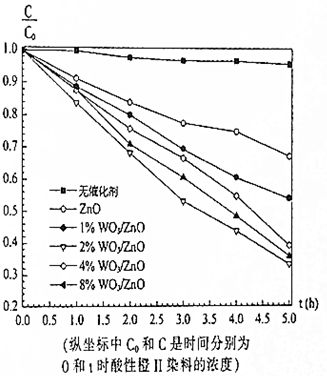 在紫外光照射下,利用WO3/ZnO光催化剂降解酸性橙Ⅱ染料废水的实验所得曲线如图.下列说法错误的是( )
在紫外光照射下,利用WO3/ZnO光催化剂降解酸性橙Ⅱ染料废水的实验所得曲线如图.下列说法错误的是( )| A. | 不加催化剂时,紫外光照射降解酸性橙Ⅱ染料废水反应速率较慢 | |
| B. | 单一ZnO材料也是降解酸性橙Ⅱ染料废水的催化剂 | |
| C. | 2%WO3/ZnO的催化效果最好 | |
| D. | 由图中可以看出,光降解酸性橙Ⅱ染料是一个可逆反应 |
查看答案和解析>>
科目: 来源: 题型:解答题
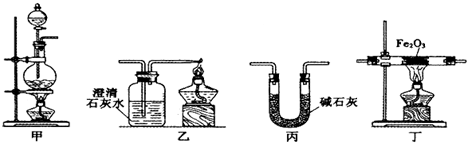
| 加热方式 | 通CO加热 时间/min | 澄清石灰水变 浑浊时间/min | 产物颜色 | 产物能否全部 被磁铁吸引 |
| 酒精灯 | 30 | 5 | 黑色 | 能 |
| 酒精喷灯 | 30 | 1 | 黑色 | 能 |
查看答案和解析>>
科目: 来源: 题型:解答题
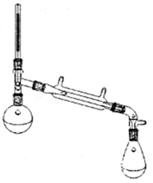 环乙烯是一种重要的化工原料,实验室常用下列反应制备环乙烯:
环乙烯是一种重要的化工原料,实验室常用下列反应制备环乙烯: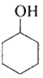 $→_{△}^{H_{2}SO_{4}}$
$→_{△}^{H_{2}SO_{4}}$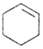 +H2O
+H2O| 物质 | 沸点(℃) | 密度(g•cm-3,20℃) | 溶解性 |
| 环己醇 | 161.1(97.8)* | 0.9624 | 能溶于水 |
| 环己烯 | 83(70.8)* | 0.8085 | 不溶于水 |
查看答案和解析>>
科目: 来源: 题型:解答题
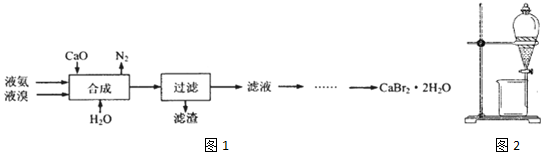
查看答案和解析>>
科目: 来源: 题型:解答题
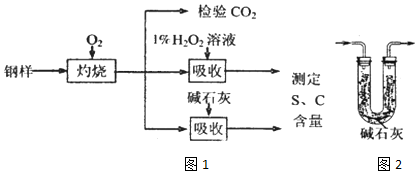
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | SiO2$\stackrel{H_{2}O}{→}$H2SiO3$\stackrel{NaOH(aq)}{→}$Na2SiO3 | |
| B. | 饱和食盐水$\stackrel{NH_{3}•CO_{2}}{→}$NaHCO3(s)$\stackrel{△}{→}$Na2CO3(s) | |
| C. | 海水$\stackrel{熟石灰}{→}$Mg(OH)2(s)$\stackrel{盐酸}{→}$MgCl2(aq)$\stackrel{电解}{→}$Mg(s) | |
| D. | NH3$→_{催化剂,△}^{O_{2}}$N2$\stackrel{O_{2},H_{2}O}{→}$HNO3 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | pH=l 的溶液中:Ba2+、Fe3+、Cl-、SCN- | |
| B. | 能使酚酞变红的溶液:Ca2+、K+、HCO3-、CO32- | |
| C. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=10-12的溶液中:NH4+、Cu2+、NO3-、SO42- | |
| D. | 由水电离的c(H+)=10-12mol•L-1的溶液中:Na+、Al3+、Cl-、NO3- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 铜跟稀HNO3反应:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| B. | 向硫酸铝溶液中加入过量氨水:Al3++3OH-═AlO2-+2H2O | |
| C. | 向Ag(NH3)2NO3溶液中加入盐酸:Ag(NH3)2+2H+═Ag++2NH4+ | |
| D. | NaHSO4溶液和Ba(OH)2溶液混合后溶液呈中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com