
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:多选题
| 容器编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | ||
| N2 | H2 | NH3 | NH3 | ||
| ① | 500 | 1 | 3 | 0 | 0.5 |
| ② | 500 | 0.6 | 1.8 | 0 | |
| ③ | 550 | 0 | 0 | 2 | a |
| A. | 容器①、②中反应的平衡常数不相等 | |
| B. | 达平衡时,容器②中H2的转化率大于25% | |
| C. | a<0.5 | |
| D. | 起始时向容器①中充入1 mol N2、2 mol H2、0.5 mol NH3,则反应将向逆反应方向进行 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
 25℃时,部分物质的电离平衡常数如表所示:
25℃时,部分物质的电离平衡常数如表所示:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | BaSO4比BaCO3溶解度小,所以BaCO3不可能转化为BaSO4 | |
| B. | BaCO3、BaSO4均不溶于水,所以都可以做钡餐试剂 | |
| C. | 该温度下,BaCO3若要在Na2SO4溶液中转化为BaSO4,则Na2SO4浓度至少为2.2×10-6 mol•L | |
| D. | 任何温度下,向Na2CO3溶液中加入BaCl2和Na2SO4,当两种沉淀共存时,c(SO42-)/c(CO32-)=4.4×10-3 |
查看答案和解析>>
科目: 来源: 题型:解答题
| NH3•H2O | 2×10-5 |
| HNO2 | 7×10-4 |
| HClO | 3×10-8 |
| H2CO3 | K1=4×10-7 K2=4×10-11 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 肯定不含I- | B. | 肯定含有Na+ | ||
| C. | 肯定不含SO42-肯定含有SO32- | D. | 不能肯定是否含有SO42 |
查看答案和解析>>
科目: 来源: 题型:推断题
| 阳离子 | Na+、H+、Ba2+ |
| 阴离子 | OH-、CO32-、SO42- |
查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:选择题
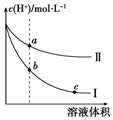 某温度下,等体积、c(H+)相同的盐酸和醋酸溶液分别加水稀释,溶液中的c(H+)随溶液体积变化的曲线如图所示.据图判断下列说法正确的是( )
某温度下,等体积、c(H+)相同的盐酸和醋酸溶液分别加水稀释,溶液中的c(H+)随溶液体积变化的曲线如图所示.据图判断下列说法正确的是( )| A. | 曲线Ⅱ表示的是盐酸的变化曲线 | |
| B. | b点溶液的导电性比c点溶液的导电性强 | |
| C. | 取等体积的a点、b点对应的溶液,消耗的NaOH的量相同 | |
| D. | b点酸的总浓度大于a点酸的总浓度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com