
科目: 来源: 题型:解答题
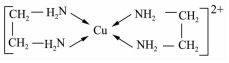
 ;
;查看答案和解析>>
科目: 来源: 题型:解答题
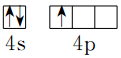
 近年我国汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物.回答下列问题:
近年我国汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物.回答下列问题:| 容器代号 | NO | N2 | O2 |
| A | 2 | 0 | 0 |
| B | 0 | 1 | 1 |
| C | 0.4 | 0.6 | 0.8 |
| D | 1 | 0.5 | 0.4 |
查看答案和解析>>
科目: 来源: 题型:选择题
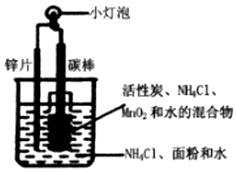 干电池模拟实验装置如图.下列说法不正确的是( )
干电池模拟实验装置如图.下列说法不正确的是( )| A. | 碳棒作正极,锌片作负极 | |
| B. | 电流方向从碳棒流向锌片,电子则相反 | |
| C. | NH4Cl是电解质,在锌片逐渐消耗过程中 MnO2不断被还原 | |
| D. | 该电池是二次电池,该废旧电池中锌可回收 |
查看答案和解析>>
科目: 来源: 题型:推断题
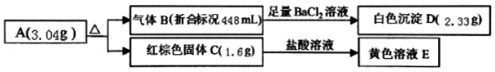
查看答案和解析>>
科目: 来源: 题型:选择题
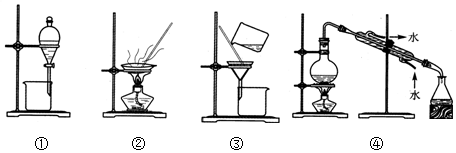
| A. | 装置①用于分离苯和水 | |
| B. | 装置②用于分离乙醇中的水 | |
| C. | 装置③用于分离FeCl3和Fe(SCN)3 | |
| D. | 装置④用于分离氯化钠和氯化铵固体 |
查看答案和解析>>
科目: 来源: 题型:解答题
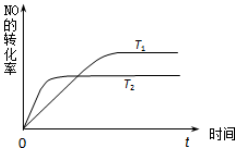
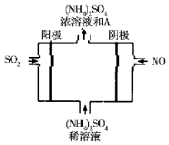 近年来,雾霾天气频繁出现,严重影响人们的生活和健康.其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等.因此,对PM2.5,SO2,NOx等进行研究具有重要意义.请回答下列问题:
近年来,雾霾天气频繁出现,严重影响人们的生活和健康.其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等.因此,对PM2.5,SO2,NOx等进行研究具有重要意义.请回答下列问题:| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
| 物质 温度/℃ | 活性炭 | NO | CO2 | N2 |
| 初始 | 3.000 | 0.10 | 0 | 0 |
| T1 | 2.960 | 0.020 | 0.040 | 0.040 |
| T2 | 2.975 | 0.050 | 0.025 | 0.025 |
查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 碳酸氢铵 | B. | 亚硫酸铵 | C. | 溴化铵 | D. | 氯化铵 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 1:1 | B. | 4:3 | C. | 3:1 | D. | 3:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com