
科目: 来源: 题型:选择题
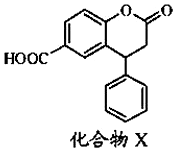
| A. | X的分子式为C16H11O4 | |
| B. | X分子中有3种不同的官能团 | |
| C. | X分子中3个六元环可能处于同一平面 | |
| D. | 即能发生酯化反应,又能发生水解反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. |  蒸干CuCl2饱和溶液制备无水CuCl2 | |
| B. | 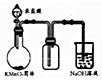 实验室制取并收集少量纯净氯气 | |
| C. | 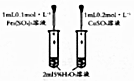 研究催化剂对H2O2分解速率的影响 | |
| D. | 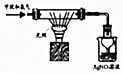 验证甲烷和氧气光照条件下发生取代反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2.0gH218O与D2O的混合物中所含中子数为NA | |
| B. | 50mL18mol•L-1浓硫酸与足量铜供热,转移电子数为0.9NA | |
| C. | 0.1molCl2通入含0.1molFeBr2溶液中,被氧化的溴离子数为0.2NA | |
| D. | 标准状况下,2.24LNO和足量O2反应生成物中含有NO2分子数为0.1NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 古代利用明矾溶液的酸性清除铜镜表面的铜锈 | |
| B. | Ba2+对人体无毒,故BaSO4在医学上可用作钡餐 | |
| C. | 侯氏制碱法工业过程中应用了物质溶解度的差异 | |
| D. | “煤改气”、“煤改电”等工程有利于减少雾霾 |
查看答案和解析>>
科目: 来源: 题型:选择题
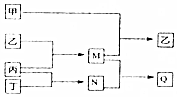 分别由短周期元素m、n、p、q组成的单质依次为甲、乙、丙、丁,有关反应关系如图所示(部分产物省略).其中甲为黄绿色气体,M、N均为10电子分子且M的水溶液呈碱性,Q为离子化合物,下列说法中正确的是( )
分别由短周期元素m、n、p、q组成的单质依次为甲、乙、丙、丁,有关反应关系如图所示(部分产物省略).其中甲为黄绿色气体,M、N均为10电子分子且M的水溶液呈碱性,Q为离子化合物,下列说法中正确的是( )| A. | 原子半径的大小m>q>n>p | |
| B. | 元素非金属性q>n>p | |
| C. | Q的溶液可以保存在细口玻璃试剂瓶 | |
| D. | n的氧化物的水化物一定为强酸 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验目的 | 玻璃仪器 |
| A | 将溴水滴入KI溶液中,从溶液中分离生成的I2 | 胶头滴管、试管、漏斗、玻璃棒、烧杯 |
| B | 实验室通过蒸馏的方法除去自来水中含有的Cl-等杂质制取蒸馏水 | 酒精灯、圆底烧瓶、冷凝管、尾接管、锥形瓶 |
| C | 用植物油提取溴水中的Br2 | 铁架台、分液漏斗、玻璃棒、烧杯 |
| D | 用浓氨水和氢氧化钠固体制取氨气 | 酒精灯、烧杯、导管、集气瓶 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 5.8g熟石膏(2CaSO4•H2O)含有的结晶水分子数为0.02NA | |
| B. | 1mol CnH2n-2(n≥2)中所含的共用电子对数为(3n+1)NA | |
| C. | 60克的乙酸和葡萄糖混合物充分燃烧消耗2NA个O2 | |
| D. | 在K37ClO3+6H35Cl(浓)═KCl+3Cl2↑+3H2O反应中,若有212克氯气生成,则反应中电子转移的数目为5NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验目的 | 实验操作 |
| A | 分离苯和四氯化碳 | 用分液漏斗进行分液 |
| B | 制备Fe(OH)3胶体 | 向饱和FeCl3溶液中滴加氨水并不断搅拌 |
| C | 除去Na2CO3固体中的NaHCO3 | 用酒精灯灼烧固体混合物 |
| D | 制取NH3 | 直接加热NH4Cl固体,用向下排空气法收集气体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题
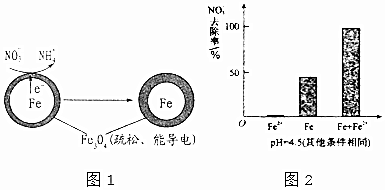
| 初始pH | pH=2.5 | pH=4.5 |
| 1小时pH | 接近中性 | 接近中性 |
| 24小时pHNO3-的去除率 | 接近100% | <50% |
| 铁的最终物质形态 | 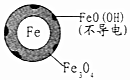 | 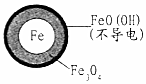 |
查看答案和解析>>
科目: 来源: 题型:选择题
 某化学小组拟设计微生物燃料电池将污水中的乙二胺[H2N(CH2)2NH2]氧化成环境友好的物质,工作原理如图所示(a、b均为石墨电极).下列分析正确的是( )
某化学小组拟设计微生物燃料电池将污水中的乙二胺[H2N(CH2)2NH2]氧化成环境友好的物质,工作原理如图所示(a、b均为石墨电极).下列分析正确的是( )| A. | a 电极发生反应:H2NCH2CH2NH2+16e-+4H2O═2CO2↑+N2↑+16H+ | |
| B. | 质子交换膜处H+由右向左移动 | |
| C. | 该电池在微生物作用下将化学能转化为电能 | |
| D. | 开始放电时b极附近pH不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com