
科目: 来源: 题型:选择题
| A. | Cu2(OH)2CO3$\stackrel{H_{2}SO_{4}}{→}$CuSO4(aq)$\stackrel{Na}{→}$Cu | |
| B. | 饱和食盐水$\stackrel{NH_{3}•CO_{2}}{→}$NaHCO3$\stackrel{△}{→}$Na2CO3 | |
| C. | 海水$\stackrel{熟石灰}{→}$Mg(OH)2$\stackrel{△}{→}$MgO$\stackrel{电解}{→}$Mg | |
| D. | NH3$→_{催化剂,△}^{O_{2}}$N2$\stackrel{O_{2}•H_{2}O}{→}$HNO3 |
查看答案和解析>>
科目: 来源: 题型:选择题
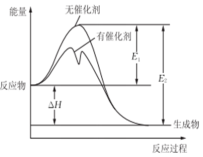 2SO2(g)+O2(g)?2SO3(g)反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能.下列有关叙述正确的是( )
2SO2(g)+O2(g)?2SO3(g)反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能.下列有关叙述正确的是( )| A. | 该反应为吸热反应 | |
| B. | E1-E2=△H | |
| C. | 升高温度,不会提高活化分子的百分数 | |
| D. | 使用催化剂使该反应的化学平衡常数发生改变 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 因为合金在潮湿的空气中易形成原电池,所以合金耐腐蚀性都较差 | |
| B. | 在NaCl和KBr的混合溶液中滴加AgNO3溶液,一定先产生淡黄色沉淀 | |
| C. | 11.2 g Fe在高温下与足量水蒸气反应,生成的H2分子数目为0.3×6.02×1023 | |
| D. | 室温下,体积、pH均相同的HA和HB两种酸分别与足量的锌反应,HA放出的氢气多,说明酸性HB>HA |
查看答案和解析>>
科目: 来源: 题型:选择题
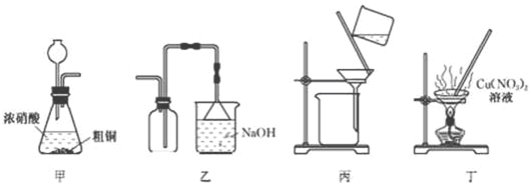
| A. | 用装置中制备NO2 | B. | 用装置乙收集NO2 | ||
| C. | 用装置丙过滤除去固体杂质 | D. | 装置丁蒸发至干得纯净硝酸铜晶体 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用白醋除铁锈:Fe2O3•xH2O+6H+═(3+x)H2O+2Fe3+ | |
| B. | 用惰性电极电解 MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH- | |
| C. | 向NH4Al(SO4)2溶液中加入过量的 NaOH溶液:Al3++4OH-═AlO2-+2H2O | |
| D. | 向含NH3的污水中加入NaClO将其转化为N2:3ClO-+2NH3═3Cl-+N2↑+3H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原子半径的大小顺序:r(Y)>r(Z)>r(W) | |
| B. | Y元素在元素周期表中的位置是第2周期第V族 | |
| C. | 元素Y的简单气态氢化物的热稳定性比Z的强 | |
| D. | 只含X、Y、Z三种元素的化合物,可能是离子化合物,也可能是共价化合物 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | SO2具有还原性,可用于漂白纸浆 | |
| B. | 碳酸氢钠能与碱反应,可用作食品的膨松剂 | |
| C. | 四氯化碳密度比水大,可用于萃取溴水中的Br2 | |
| D. | MgO、Al2O3的熔点都很高,都可用作耐火材料 |
查看答案和解析>>
科目: 来源: 题型:解答题
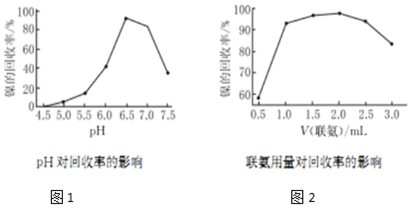
查看答案和解析>>
科目: 来源: 题型:多选题
| 选项 | 实验操作和现象 | 结论 |
| A | 在酒精灯上加热铝箔,铝箔熔化但不滴落 | 熔点:铝>氧化铝 |
| B | 向某溶液中先滴加KSCN溶液,再滴加少量氯水,先无明显现象,后溶液变成血红色 | 原溶液中含有Fe3+,没有Fe2- |
| C | KNO3和KOH混合溶液中加入铝粉并加热,管口放湿润的红色石蕊试纸,试纸变为蓝色 | NO3-还原为NH3 |
| D | 向加入了几滴酚酞试液的Na2CO3溶液中滴加BaCl2溶液,红色逐渐褪去 | Na2CO3溶液中存在水解平衡 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 无色澄清透明溶液中:H+、Cu2+、SO42-、Cl- | |
| B. | 0.1 mol•L-1AlCl3溶液中:H+、Na+、Cl-、SO42- | |
| C. | pH=13的溶液中:NH4+、K+、NO3-、HCO3- | |
| D. | c((OH-)<$\sqrt{{K}_{w}}$的溶液:Ca2+、Fe2+、NO3-、ClO- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com