
科目: 来源: 题型:解答题
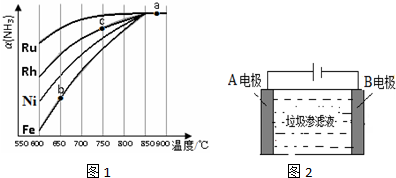
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 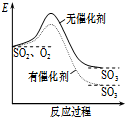 如图表示SO2氧化反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| B. | 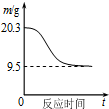 如图表示0.1molMgCl2•6H2O在空气中充分加热时固体质量随时间的变化 | |
| C. | 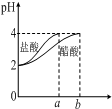 如图表示分别稀释1mLpH=2的盐酸和醋酸时溶液pH的变化,图中b>100mL | |
| D. |  如图表示平衡2NO2(g)?N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化 |
查看答案和解析>>
科目: 来源: 题型:解答题
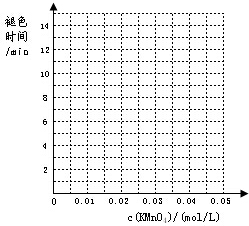 草酸(H2C2O4)是一种二元弱酸,部分性质如下:能溶于水,易溶于乙醇;大约在175℃升华(175℃以上分解生成H2O、CO2和CO);H2C2O4+Ca(OH)2=CaC2O4↓+2H2O.现用H2C2O4进行如下实验:
草酸(H2C2O4)是一种二元弱酸,部分性质如下:能溶于水,易溶于乙醇;大约在175℃升华(175℃以上分解生成H2O、CO2和CO);H2C2O4+Ca(OH)2=CaC2O4↓+2H2O.现用H2C2O4进行如下实验:
| 实验组别 | c(H2C2O4) /(mol/L) | V(H2C2O4) /ml | c(KMnO4) /(mol/L) | V(KMnO4) /ml | c(H2SO4) /(mol/L) | 褪色所需时间 | 实验 目的 |
| 1 | 0.2 | 2 | 0.0025 | 4 | 0.12 | 6′55″ | (a)探究KMnO4溶液浓度对化学反应速率的影响 |
| 0.2 | 2 | 0.005 | 4 | 0.12 | 5′17″ | ||
| 0.2 | 2 | 0.01 | 4 | 0.12 | 3′20″ | ||
| 0.2 | 2 | 0.02 | 4 | 0.12 | 9′05″ | ||
| 0.2 | 2 | 0.03 | 4 | 0.12 | 11′33″ | ||
| 0.2 | 2 | 0.04 | 4 | 0.12 | 14′20″ |
查看答案和解析>>
科目: 来源: 题型:填空题
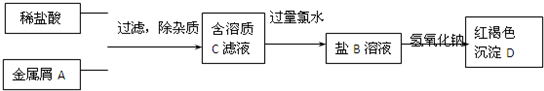
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验操作与现象 | 结论 |
| A | 向蛋白质溶液中滴加Pb(NO3)2溶液,产生白色沉淀,加水沉淀不消失 | 蛋白质发生了变性 |
| B | 测定浓度为 0.1mol•L-1CH3COONa与HCOONa 溶液的pH,CH3COONa溶液的pH较大 | 酸性:CH3COOH>HCOOH |
| C | 向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液,出现白色沉淀 | 溶液X中一定含有SO42- |
| D | 向浓度均为0.1mol•L-1NaCl和NaI混合溶液中滴加少量0.l mol•L-1AgNO3溶液,出现黄色沉淀 | Ksp(AgI)<Ksp(AgCl) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 含有大量Fe3+的溶液中:Na+、Fe2+、Br-、SO42- | |
| B. | 1.0 mol/L KMnO4的溶液中:H+、Na+、Cl-、SO42- | |
| C. | 能与铝反应放出H2的溶液中:K+、Mg2+、SO42-、NO3- | |
| D. | 水电离的c(H+)和C(OH-)之积为l×l0-20mol2•L-2的溶液中:Na+、K+、CO32-、Cl- |
查看答案和解析>>
科目: 来源: 题型:多选题

| A. | 已知该步转化过程中的原子利用率为100%,则X为CO2 | |
| B. | 有机物F属于芳香族化合物,但不属于芳香烃 | |
| C. | (C9H8O3)n既是高分子G的化学式也是其链节的化学式 | |
| D. | 已知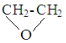 经水解生成乙二醇,则F、G在一定条件下水解,可得相同的产物 经水解生成乙二醇,则F、G在一定条件下水解,可得相同的产物 |
查看答案和解析>>
科目: 来源: 题型:选择题
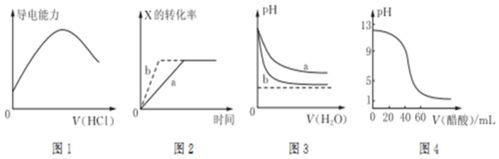
| A. | 图1表示向氨水中通入HC1气体,溶液的导电能力变化 | |
| B. | 图2所示反应:X(g)+2Y(g)?3Z(g),b曲线表示的一定是增大压强 | |
| C. | 图3可表示pH相同的NaOH溶液与氨水稀释过程的pH变化,其中曲线a对应氨水 | |
| D. | 图4可表示用0.100 0 mol/L,醋酸滴定40.00 mL 0.100 0 mol/L NaOH溶液得到的滴定曲线 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com