
科目: 来源: 题型:选择题
| 选项 | 操作、现象 | 解释或结论 |
| A | 向饱和Na2CO3溶液中通入少量CO2无浑浊出现 | 生成NaHCO3量少未使溶液饱和 |
| B | 用NaOH标准溶液滴定未知浓度盐酸,滴定终点时俯视读数 | 测定盐酸浓度偏低 |
| C | 向氯化钡溶液通入过量SO2无明显现象,再①通氯气②通氨气,两种操作均会产生白色沉淀 | 白色沉淀①为硫酸钡,②为亚硫酸钡 |
| D | 向1ml 0.2mol/L NaOH溶液中滴入2滴0.1mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol/LFeCl3溶液,又生成红褐色沉淀 | 在相同条件下,溶解度Mg(OH)2>Fe(OH)3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
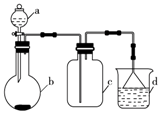 实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )| 选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
| A | 浓氨水 | CaO | NH3 | H2O |
| B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
| C | 浓硝酸 | Cu | NO2 | H2O |
| D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Fe3+、Cu2+、Fe2+氧化性依次减弱 | |
| B. | 可发生反应:Fe+2Fe3+═3Fe2+ | |
| C. | Fe、Fe2+、Cu还原性依次减弱 | |
| D. | 将铁、铜混合粉末放入FeCl3溶液中,铁粉先溶解 |
查看答案和解析>>
科目: 来源: 题型:选择题
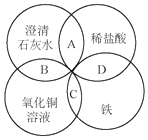 铁、稀盐酸、澄清石灰水、氯化铜溶液是中学化学中常见的物质,四种物质间的反应关系如图所示.图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应反应的离子方程式书写正确的是( )
铁、稀盐酸、澄清石灰水、氯化铜溶液是中学化学中常见的物质,四种物质间的反应关系如图所示.图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应反应的离子方程式书写正确的是( )| A. | OH-+HCl═H2O+Cl- | B. | Ca(OH)2+Cu2+═Ca2++Cu(OH)2 | ||
| C. | Fe+Cu2+═Cu+Fe2+ | D. | Fe+2H+═Fe3++2H2↑ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标况下,1 mol水分子占有的体积为 22.4L | |
| B. | 17g OH-中质子总数比电子总数多 NA | |
| C. | 物质的量浓度为 0.5mol/L的 MgCl2溶液中,含有 Cl-的数目为 NA | |
| D. | 4g氦气中所含氦原子的数目为 NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1×10-4mol/L | B. | 1×10-3mol/L | C. | 4×10-4mol/L | D. | 4×10-3mol/L |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 6.02×1023就是阿伏加德罗常数 | |
| B. | 1mol氧含 6.02×1023个 O2 | |
| C. | 1mol任何气体所含的气体分子数目都相等 | |
| D. | 摩尔是国际单位制中的一个基本物理量 |
查看答案和解析>>
科目: 来源: 题型:选择题
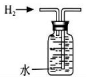 | 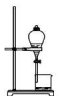 | 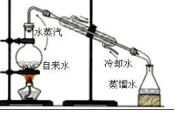 | 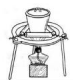 |
| A.排水法收集 H2 | B.分离油和水 | C.实验室制取少量蒸馏水中 | D.从饱和食盐水提取 NaCl晶体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 使用萃取的方法,并选用酒精作萃取剂 | |
| B. | 萃取使用的主要仪器是分液漏斗,在使用前要先检验其是否漏液 | |
| C. | 分液操作时,下层液体从分液漏斗下口放出后,再将上层液体从下口放出到另一烧杯中 | |
| D. | 从分液漏斗中分离出的就是纯净的碘单质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com