
科目: 来源: 题型:选择题
| A. | 绿色食品是不含任何化学物质的食品 | |
| B. | 灼烧某物质时,用肉眼直接观察到火焰呈黄色,则可判断该物质一定含钠元素 | |
| C. | 将镁条放在空气中充分燃烧,可以得到三种固体 | |
| D. | 称取等质量的两份铝粉,分别加入过量的稀HCl和过量的NaOH溶液,则放出氢气的体积相等(同温同压下) |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
| 反应阶段 | 溶液中的存在的金属离子 | 残留的金属粉末 | 发生的离子反应 |
| 第一阶段 | 只有一种 | 有两种 | (1) |
| 第二阶段 | 只有一种 | 只有一种 | |
| 第三阶段 | 只有两种 | (2) | (3) |
| 笫四阶段 | 有三种 | (4) | |
| 笫五阶段 | (5) |
查看答案和解析>>
科目: 来源: 题型:解答题
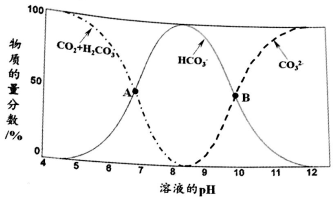
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 乙烯和乙烷都能发生加聚反应 | |
| B. | 乙烯和苯都能与溴水反应 | |
| C. | 乙醇不能发生取代反应 | |
| D. | 甲烷和氯气反应生成一氯甲烷与苯和硝酸反应生成硝基苯的反应类型相同 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A | B | C | D |
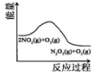 | 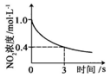 |  | 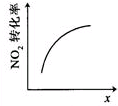 |
| 升高温度,平衡常数 减小 | 0~3s内,反应速率为v(NO2)=0.2mol•L-1•s-1 | t1时仅加入催化剂,平 衡向正方向移动 | 达平衡时,仅改变x, 则x为c(O2) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题

| 浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
查看答案和解析>>
科目: 来源: 题型:选择题
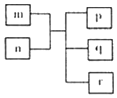 短周期主族元素X、Y、Z、W原子序数依次递增,Y原子最外层电子数为次外层电子数的二倍.m为元素Y的单质,n为元素Z的最高价氧化物的水化物,p、q、r分别为上述四种元素组成的二元化合物.下列说法正确的是( )
短周期主族元素X、Y、Z、W原子序数依次递增,Y原子最外层电子数为次外层电子数的二倍.m为元素Y的单质,n为元素Z的最高价氧化物的水化物,p、q、r分别为上述四种元素组成的二元化合物.下列说法正确的是( )| A. | 原子半径Y<Z<W | |
| B. | 简单气态氢化物的稳定性Y>Z>W | |
| C. | 简单气态氢化物沸点Y>Z | |
| D. | X、Z、W三种元素可以形成离子化合物 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 达到化学平衡时,4v正(O2)=5v逆(NO) | |
| B. | 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 | |
| C. | 达到化学平衡时,NH3(g)、O2(g) NO(g)、H2O(g)的浓度比为4:5:4:6 | |
| D. | 化学反应速率关系是:2v正(NH3)=3v正(H2O) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com