
科目: 来源: 题型:实验题
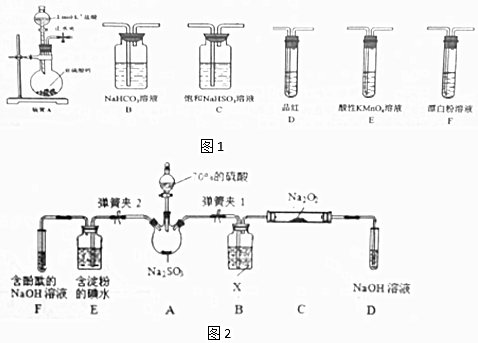
| 操作步骤 | 实验现象 | 解释原因 |
| 关闭弹簧夹2,打开弹簧夹1,注入硫酸至浸没三颈烧瓶中固体 | 若将带火星的木条放在D试管口处,木条不复燃 | SO2与Na2O2反应无O2生成,可能发生的化学反应方程式为①Na2O2+SO2=Na2SO4 |
| 若将带火星的木条放在D试管口处,木条复燃 | SO2与Na2O2反应有O2生成,发生的化学反应为:2SO2+2Na2O2═2Na2SO3+O2 | |
| 关闭弹簧夹1,打开弹簧夹2,残余气体进入E,F中. | E中②E 中溶液蓝色褪去 | E中反应的离子方程式③SO2+I2+2H2O=2I-+SO42-+4H+ |
| F中④F 中红色变浅或褪色 | F中反应为2OH-+SO2═SO32-+H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1,2-二甲苯也称邻二甲苯 | |
| B. | 氨基乙酸与a-氨基丙酸的混合物一定条件下脱水能生成4种二肽 | |
| C. | 苯与溴水不能发生加成反应,所以两者混合后无明显现象 | |
| D. | C5H10O2属于羧酸的同分异构体有4种 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 煤炭经气化、液化和干馏等处理后,可转化为清洁能源 | |
| B. | “绿蚁新醅酒,红泥小火炉”,“新醅酒”即新酿的酒,在酿酒的过程中,葡萄糖发生了水解反应 | |
| C. | 地沟油和矿物油的主要化学成分相同 | |
| D. | 聚氯乙烯可以用作食品包装袋 |
查看答案和解析>>
科目: 来源: 题型:解答题
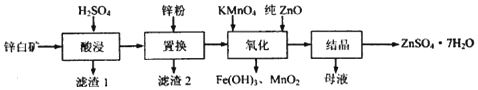
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 6.4 | 8.0 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验1 | 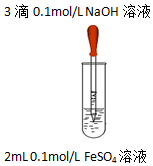 | 实验现象 |
| 液面上方产生白色絮状沉淀,迅速变为灰绿色,振荡,试管壁上有红褐色沉淀生成. |
| 试管中10mL NaOH溶液 | 滴加 FeSO4溶液 | 实验现象 | |
| 实验2 | 6mol/L NaOH溶液 | 0.2mol/L FeSO4溶液 | 产生悬浮于液面的白色沉淀(带有少量灰绿色),沉淀下沉后,大部分灰绿色变为白色沉淀 |
| 实验3 | 6mol/L NaOH溶液 | 0.1mol/L FeSO4溶液 | 产生悬浮于液面的白色沉淀(带有极少量灰绿色),沉淀下沉后,底部都为白色沉淀 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
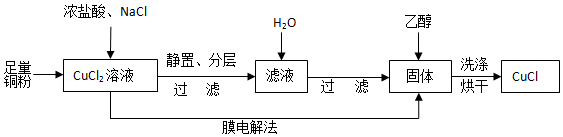
查看答案和解析>>
科目: 来源: 题型:选择题
 生产上用过量烧碱溶液处理某矿物(含Al2O3、MgO),过滤后得到滤液用NaHCO3溶液处理,测得溶液pH和Al(OH)3生成的量随加入NaHCO3溶液体积变化的曲线如下:下列有关说法不正确的是( )
生产上用过量烧碱溶液处理某矿物(含Al2O3、MgO),过滤后得到滤液用NaHCO3溶液处理,测得溶液pH和Al(OH)3生成的量随加入NaHCO3溶液体积变化的曲线如下:下列有关说法不正确的是( )| A. | NaHCO3溶液的物质的量浓度为0.8 mol/L | |
| B. | b点与c点溶液所含微粒种类相同 | |
| C. | a点溶液中存在的离子是Na+、AlO2-、OH-、H+ | |
| D. | 生成沉淀的离子方程式为:HCO3-+AlO2-+H2O═Al(OH)3↓+CO32- |
查看答案和解析>>
科目: 来源: 题型:解答题
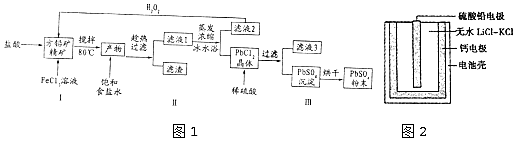
| 物质 | Ksp | 物质 | 开始沉淀时pH | 完全沉淀时pH |
| PbSO4 | 1.0×10-8 | Fe(OH)3 | 2.7 | 3.7 |
| PbCl2 | 1.6×10-5 | Fe(OH)2 | 6 | 7.04 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com