
科目: 来源: 题型:选择题
| A. | 第三周期第ⅤA族 | B. | 第四周期第ⅤA族 | C. | 第五周期第ⅢA族 | D. | 第四周期第ⅢA族 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向含有FeCl2的溶液中通入适量氯气,当有1molFe2+被氧化时,该反应转移电子数目为3NA | |
| B. | 40gCuO和Cu2S混合物中所含铜原子的数目不等于0.5NA | |
| C. | 含0.1molNH4HSO4的溶液中,阳离子数目略小于0.2NA | |
| D. | C3H8分子中的2个H原子分别被1个-NH2和1个-OH取代,1mol此有机物所含共用电子对数目为13NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 第四周期第ⅢA族 | B. | 第四周期第ⅦA族 | C. | 第三周期第ⅣA族 | D. | 第三周期第ⅣB族 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | a+2 | B. | a+8 | C. | a+26 | D. | a+18 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | X | Y | Z |
| A | Cu | HNO3 | Fe(NO3)3 |
| B | FeCl3 | Zn | NaHCO3 |
| C | O2 | NH3 | SO2 |
| D | NH4Al(SO4)2 | Ba(NO3)2 | NaOH |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 铝溶于氢氧化钠溶液:Al+2OH-+H2O═A1O2-+2H2↑ | |
| B. | 用H2O2从酸化的海带灰浸出液中提取碘:2I-+H2O2═I2+2OH- | |
| C. | 将等体积等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| D. | 向苯酚钠溶液中通入少量的CO2:2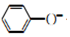 +CO2+H2O→2 +CO2+H2O→2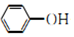 +CO${\;}_{3}^{2-}$ +CO${\;}_{3}^{2-}$ |
查看答案和解析>>
科目: 来源: 题型:解答题
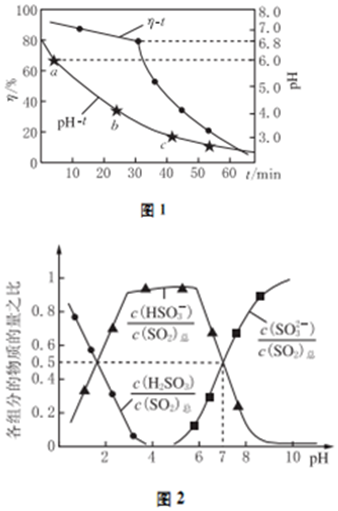
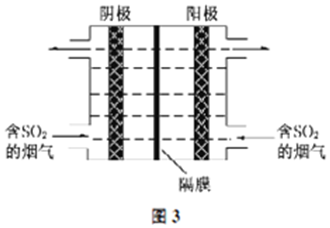
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体 | |
| B. | 常温下,将稀CH3COONa溶液加水稀释后,溶液中n(H+)•n(OH-)不变 | |
| C. | 标准状况下,5.6L由CH4与C2H4组成的混合气体中含有的氢原子数目为6.02×1023 | |
| D. | 一定条件下,将0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3KJ,则其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6KJ•mol-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.1 mol•L-1 HC1$→_{△}^{MnO_{2}}$C12$\stackrel{石灰水}{→}$Ca(ClO)2(aq) | |
| B. | Al3+$\stackrel{过量氨水}{→}$A1O2-$\stackrel{CO_{2}}{→}$Al(OH)3 | |
| C. | A1$\stackrel{Na(OH)(aq)}{→}$NaA1O2(aq) $\stackrel{△}{→}$NaAlO2(s) | |
| D. | MgO(s) $\stackrel{HNO_{3}(aq)}{→}$Mg(NO3)2(aq)$\stackrel{电解}{→}$Mg(s) |
查看答案和解析>>
科目: 来源: 题型:实验题
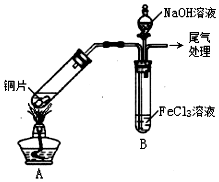 某化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示(夹持仪器已略去)
某化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示(夹持仪器已略去)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com