
科目: 来源: 题型:选择题
| A. | 5、9、6 | B. | 4、9、6 | C. | 3、9、7 | D. | 5、9、10 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 有机物 | 同分异构体数目 |
| A | 分子式为C6H14且含有三个甲基 | 2 |
| B | 分子式为C5H10,不能使溴的四氯化碳溶液褪色 | 5 |
| C | 分子式为C4H10O,不能与Na反应生成氢气 | 4 |
| D | 分子式为C4H8O2能与NaHCO3反应产生气体 | 2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:填空题
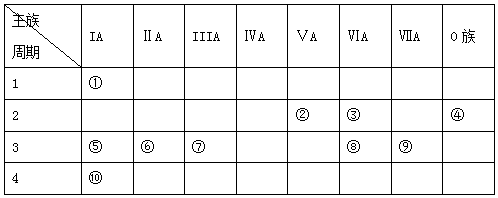
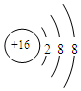 .
.查看答案和解析>>
科目: 来源: 题型:实验题
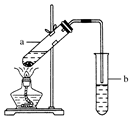 实验室常用如图所示装置制取少量乙酸乙酯.请回答下列问题:
实验室常用如图所示装置制取少量乙酸乙酯.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| H2(g) | Br2(g) | HBr(g) | |
| 1mol分子中的化学键断 裂时需要吸收的能量/kJ | 436 | 230 | 369 |
| A. | 404 | B. | 72 | C. | 230 | D. | 200 |
查看答案和解析>>
科目: 来源: 题型:实验题
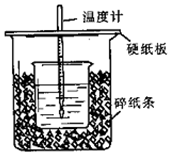 50 mL 0.50 mol•L-1盐酸与50 mL 0.55 mol•L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50 mL 0.50 mol•L-1盐酸与50 mL 0.55 mol•L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目: 来源: 题型:填空题
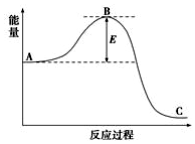 工业合成氨N2(g)+3H2(g)?2NH3(g)反应过程中的能量变化如下图所示,据图回答下列问题:
工业合成氨N2(g)+3H2(g)?2NH3(g)反应过程中的能量变化如下图所示,据图回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
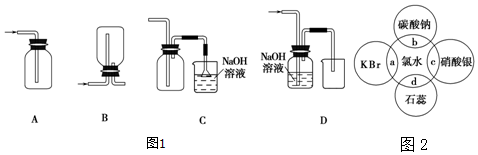
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com