
科目: 来源: 题型:选择题
| A. | 常温下,C(s)+H2O(g)?CO(g)+H2(g)不能自发进行,则该反应的△H<0 | |
| B. | 合成氨反应中使用高效催化剂可提高原料转化率 | |
| C. | 电解冶炼铝时需定期更换阳极的石墨电极 | |
| D. | 25℃时,向0.1 mol•L-1 CH3COOH溶液中加水稀释,$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$逐渐增大 |
查看答案和解析>>
科目: 来源: 题型:选择题
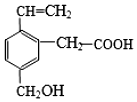 某有机物的结构如图所示,这种有机物不可能具有的性质是( )
某有机物的结构如图所示,这种有机物不可能具有的性质是( )| A. | 只有⑥ | B. | ①④ | C. | ⑤⑥ | D. | ④⑥ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 密闭容器中,2mol SO2和1mol O2充分反应,生成SO3的分子数为2 NA | |
| B. | 1L1 mol•L-1 的(NH4)2SO4 溶液中含有的 NH4+数目为2NA | |
| C. | 足量的 MnO2与 100ml 12 mol•L-1的浓盐酸充分反应,转移的电子数目为 0.6 NA | |
| D. | 常温常压下,18 mL 水含有的分子数目约为 NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 侯氏制碱法制得的是纯碱 | |
| B. | 用人参泡制药酒是利用了萃取的原理 | |
| C. | 氢氟酸刻蚀玻璃是利用了氢氟酸的强氧化性 | |
| D. | 硫酸铜溶液可用于特定环境中的消毒杀菌 |
查看答案和解析>>
科目: 来源: 题型:解答题
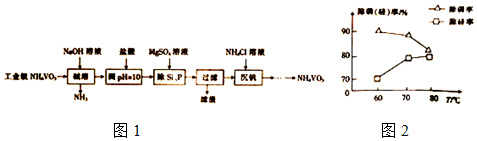
查看答案和解析>>
科目: 来源: 题型:解答题
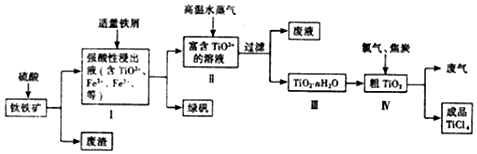
查看答案和解析>>
科目: 来源: 题型:实验题
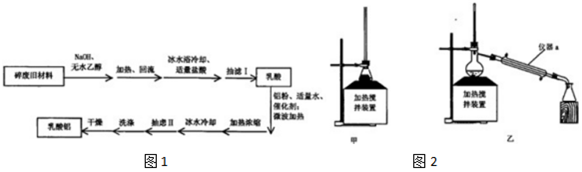
 $→_{②HCl}^{①NaOH}$CH3CH(OH)COOH$\stackrel{Al}{→}$Al[CH3CH(OH)COO]3
$→_{②HCl}^{①NaOH}$CH3CH(OH)COOH$\stackrel{Al}{→}$Al[CH3CH(OH)COO]3| 编号 | 时间/h | n(乳酸):n(铝) | ?(乳酸) | 产率(%) | 编号 | 时间/h | n(乳酸):n(铝) | ?(乳酸) | 产率(%) |
| 1 | 8 | 3.025 | 0.10 | 64.0 | 4 | 10 | 2.935 | 0.20 | 78.4 |
| 2 | 8 | 3.025 | 0.20 | 72.0 | 5 | 10 | 3.025 | 0.20 | 90.2 |
| 3 | 8 | 3.025 | 0.30 | 68.5 | 6 | 10 | 3.505 | 0.20 | 91.3 |
查看答案和解析>>
科目: 来源: 题型:推断题
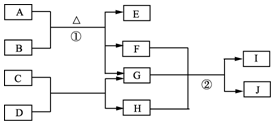 有关物质的转化关系如图1所示.A是黑色非金属单质,C、E、F均为氧化物,E、F常温下呈气态,且E能使品红褪色,G是一种常见的无色液体,I是一种难溶于水的白色胶状沉淀,能溶于B溶液.请回答下列问题:
有关物质的转化关系如图1所示.A是黑色非金属单质,C、E、F均为氧化物,E、F常温下呈气态,且E能使品红褪色,G是一种常见的无色液体,I是一种难溶于水的白色胶状沉淀,能溶于B溶液.请回答下列问题: .
.查看答案和解析>>
科目: 来源: 题型:填空题
 2016中国首艘国产航母即将竣工,8艘052D驱逐舰下水,加快了我国海军迈向“蓝水海军”的步伐.
2016中国首艘国产航母即将竣工,8艘052D驱逐舰下水,加快了我国海军迈向“蓝水海军”的步伐. .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氧化铁与醋酸:Fe2O3+6H+═2Fe3++3H2O | |
| B. | 碳酸钠与盐酸:Na2CO3+2H+═2Na++CO2↑+H2O | |
| C. | 铁片插入到硫酸铜溶液中:2Fe+3Cu2+═2Fe3++3Cu | |
| D. | 向盐酸中加入适量氨水:H++NH3•H2O═NH4++H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com