
科目: 来源: 题型:选择题
| A. | 原子半径大小顺序:W>Z>Y>X | |
| B. | X、Y、W都能与氧元素形成两种氧化物 | |
| C. | W的最高价氧化物的水化物的酸性比Z的弱 | |
| D. | W分别与X、Y形成的化合物中化学键类型相同 |
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1:3:6 | B. | 2:3:9 | C. | 9:3:1 | D. | 1:2:3 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
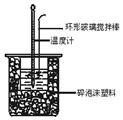 中和热测定实验中,用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH溶液进行实验,下列说法不正确的是( )
中和热测定实验中,用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH溶液进行实验,下列说法不正确的是( )| A. | 改用25mL 0.50mol/L盐酸跟25mL 0.55 mol/L NaOH溶液进行反应,求出的中和热数值和原来相同 | |
| B. | 酸碱混合时,量筒中NaOH溶液应缓缓倒入小烧杯中,不断用玻璃棒搅拌 | |
| C. | 装置中的大小烧杯之间填满碎泡沫塑料的作用是保温隔热减少热量损失 | |
| D. | 实验中应记录测量出的最高温度 |
查看答案和解析>>
科目: 来源: 题型:实验题
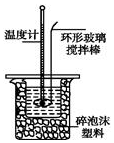 某实验小组用0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.
某实验小组用0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.| 名称 | 托盘天平 (带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |
| 试验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.6 | |
| 2 | 27.0 | 27.4 | 27.2 | 31.2 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 100 | B. | $\frac{1}{100}$ | C. | 2 | D. | $\frac{1}{2}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com