
科目: 来源: 题型:解答题
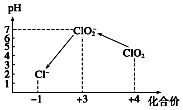 ClO2是一种黄绿色到橙黄色的气体,ClO2与Cl2的氧化性相近,被国际上公认为安全、低毒的绿色消毒剂,近几年我国用ClO2代替氯气对饮用水进行消毒.
ClO2是一种黄绿色到橙黄色的气体,ClO2与Cl2的氧化性相近,被国际上公认为安全、低毒的绿色消毒剂,近几年我国用ClO2代替氯气对饮用水进行消毒.查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | W | X | Y | Z | 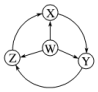 |
| A | Cl2 | FeCl2 | FeCl3 | HClx|k.Com] | |
| B | Na | Na2O2 | NaOH | NaCl | |
| C | NH3 | NO2 | HNO3 | NO | |
| D | Al | AlCl3 | NaAlO2 | Al2(SO4)3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NaOH溶液与SO2反应,当n(NaOH):n(SO2)=4:3时,4OH-+3SO2═SO32-+2HSO3-+H2O | |
| B. | 碳酸氢镁中加过量氢氧化钠:Mg2++2HCO3-+2OH-═MgCO3↓+CO32-+2H2O | |
| C. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-═BaSO4↓+H2O | |
| D. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②④ | B. | ②③⑥ | C. | ②⑤⑥ | D. | ④⑤⑥ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 电解质:胆矾、一水合氨、硫酸钡、CaO | |
| B. | 酸性氧化物:CO2、SO2、NO2、SiO2 | |
| C. | 混合物:铝热剂、干冰、水玻璃、盐酸 | |
| D. | 弱酸:氢碘酸、醋酸、碳酸、次氯酸 |
查看答案和解析>>
科目: 来源: 题型:选择题
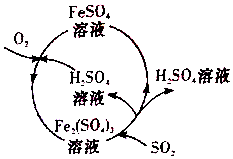 含硫煤燃烧会产生大气污染,为防治该污染,某工厂设计了新的治污方法,同时可得到化工产品,该工艺流程如图所示,下列叙述不正确的是( )
含硫煤燃烧会产生大气污染,为防治该污染,某工厂设计了新的治污方法,同时可得到化工产品,该工艺流程如图所示,下列叙述不正确的是( )| A. | 该过程中可得到化工产品H2SO4 | |
| B. | 该工艺流程是除去煤燃烧时产生的SO2 | |
| C. | 该过程中化合价发生改变的元素为Fe和S | |
| D. | 图中涉及到的反应之一为Fe2(SO4)3+SO2+2H2O═2FeSO4+2H2SO4 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na2SO3溶液使酸性高锰酸钾溶液褪色:5SO32-+6H++2MnO4-=5SO42-+2Mn2++3H2O | |
| B. | 铵明矾溶液中加入过量的氢氧化钡溶液:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O | |
| C. | 向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca 2++2HCO 3 -+2OH -=BaCO 3↓+CO 3 2- 十2H 2 O | |
| D. | 弱酸尼泊金酸( 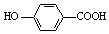 )与碳酸氢钠溶液反应: )与碳酸氢钠溶液反应: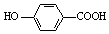 +HCO3-→ +HCO3-→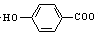 -+CO2↑+H2O -+CO2↑+H2O |
查看答案和解析>>
科目: 来源: 题型:实验题
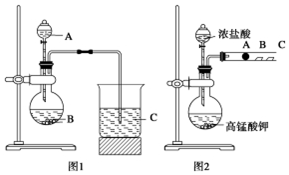
查看答案和解析>>
科目: 来源: 题型:推断题
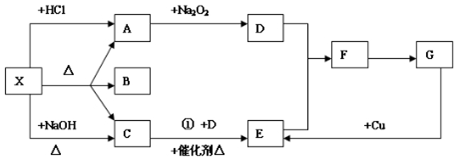
查看答案和解析>>
科目: 来源: 题型:实验题
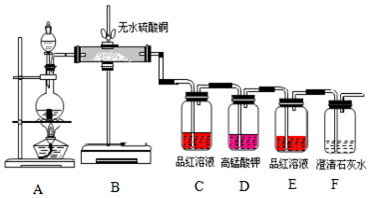
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com