
科目: 来源: 题型:实验题
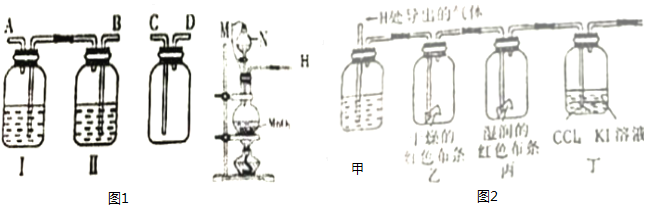
查看答案和解析>>
科目: 来源: 题型:解答题
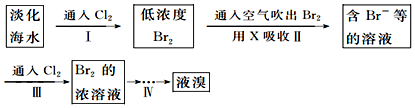
| 弱酸化学式 | HClO | H2CO3 |
| 电离常数 | K=4.7×10-8 | K1=4.3×10-7, |
| K2=5.6×10-11 |
查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | x=2 | |
| B. | 2 min内A的反应速率为0.3 mol•(L•min)-1 | |
| C. | 维持其他条件不变,将该混合物转移到固定容积为1 L的密闭容器中,再次平衡后H的浓度将大于0.4 mol•L-1 | |
| D. | 维持其他条件不变,再向容器中加入足量物质 A,最终H的浓度将达到0.5 mol•L-1 |
查看答案和解析>>
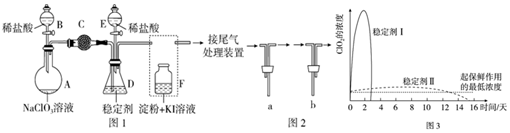
科目: 来源: 题型:实验题
 如图所示是某学生设计的实验室制备干燥Cl2及吸收多余Cl2的实验装置图,根据图中的装置和有关试剂回答下列问题.
如图所示是某学生设计的实验室制备干燥Cl2及吸收多余Cl2的实验装置图,根据图中的装置和有关试剂回答下列问题.查看答案和解析>>
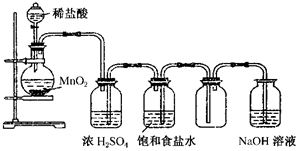
科目: 来源: 题型:实验题
 50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题:
50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题:| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | 温差(t2-t1)/℃ |
| 1 | 25.0 | 32.6 | |
| 2 | 25.1 | 31.8 | |
| 3 | 25.1 | 31.9 |
查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:填空题
 的名称是2,2,4,5-四甲基-3,3-二乙基己烷
的名称是2,2,4,5-四甲基-3,3-二乙基己烷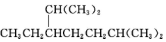 的名称为2,6-二甲基-3-乙基庚烷
的名称为2,6-二甲基-3-乙基庚烷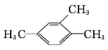 的名称是1,2,4-三甲苯
的名称是1,2,4-三甲苯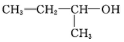 的名称是2-丁醇
的名称是2-丁醇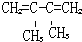 .
.查看答案和解析>>
科目: 来源: 题型:填空题
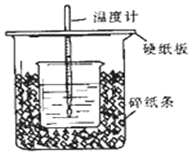 ①用50mL0.50mol/L盐酸与50mL一定浓度的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.该装置有两处明显的错误,其中一处是缺少一种玻璃仪器,该仪器的名称环形玻璃搅拌棒,另一处错误是小烧杯口和大烧杯口没有平齐.
①用50mL0.50mol/L盐酸与50mL一定浓度的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.该装置有两处明显的错误,其中一处是缺少一种玻璃仪器,该仪器的名称环形玻璃搅拌棒,另一处错误是小烧杯口和大烧杯口没有平齐.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com