
科目: 来源: 题型:选择题
| A. | 糖、油脂、蛋白质都可以生水解反应 | |
| B. | 天然纤维、聚酚纤维、光导纤维都属于有机高分子材料 | |
| C. | 大力实施矿物燃料脱硫、脱硝技术以减少硫、氮氧化物排放 | |
| D. | 镀锌铁或镀锡铁镀层破损后仍将通过牺牲阳极的阴极保护法防止腐蚀 |
查看答案和解析>>
科目: 来源: 题型:选择题
| X | Y | ||
| W | Z |
| A. | X只能形成一种氢化物 | |
| B. | W、X、Y的原子半径依次增大 | |
| C. | X的简单氢化物的热稳定性比Y的小 | |
| D. | W的最高价氧化物对应的水化物能溶于稀氨水 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 该溶液中,H+、NH4+、SO42-、I-可以大量共存 | |
| B. | 该溶液中,Ag+、K+、NO3-、NH4+可以大量共存 | |
| C. | 该溶液中,Fe2+、Fe3+、Cl-、NO3-可以大量共存 | |
| D. | 向该溶液中加入浓盐酸,每产生1 molCl2,转移电子约为6.02×1023个 |
查看答案和解析>>
科目: 来源: 题型:实验题
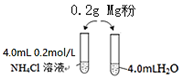 某校化学课外学习小组发现将镁粉按图投入纯水中现象不明显,而投入氯化铵溶液中,两者立即发生反应,产生大量气泡.经检验该过程产生两种气体,其中一种气体有刺激性气味.
某校化学课外学习小组发现将镁粉按图投入纯水中现象不明显,而投入氯化铵溶液中,两者立即发生反应,产生大量气泡.经检验该过程产生两种气体,其中一种气体有刺激性气味.| 序号 | 实验试剂 | 实验现象 | |
| 实验1-1 | 0.20g镁粉 | 3.0mL 0.2mol/LNH4Cl溶液 | 反应明显,有气泡产生 |
| 实验1-2 | 0.20g镁粉 | 3.0mL盐酸 | 反应不明显,几乎没有气泡产生 |
| 实验序号 | 实验试剂 | |
| 实验2-1 | 0.20g镁粉 | 3.0 mL 0.2mol/LNaCl溶液 |
| 实验2-2 | 0.20g镁粉 | 3.0 mL0.2mol/LNaNO3溶液 |
| 实验3-1 | 0.20g镁粉 | 3.0mL0.2mol/L NH4NO3溶液 |
| 实验3-2 | 0.20g镁粉 | 3.0mL0.2mol/L KNO3溶液 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 锂-磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:
锂-磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备: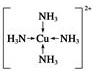 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 苯每个碳原子的未参加杂化的 2p 轨道形成大π键 | |
| B. | CH4中的 4 个 C-H 键都是 H 的 1s 轨道与 C 的 2p 轨道形成的 s-pσ键 | |
| C. | C2H4 中,每个碳原子的 sp2 杂化轨道形成σ键、未杂化的2p 轨道形成π键 | |
| D. | 乙炔分子中,每个碳原子都有两个未杂化的 2p 轨道形成π键 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 3个 | B. | 4个 | C. | 5个 | D. | 6个 |
查看答案和解析>>
科目: 来源: 题型:实验题
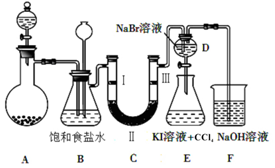
| a | b | c | d | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目: 来源: 题型:填空题
 的名称是3,3,5,5-四甲基庚烷;
的名称是3,3,5,5-四甲基庚烷;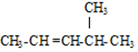 的名称是4-甲基-2-戊烯;
的名称是4-甲基-2-戊烯; ,则键线式为
,则键线式为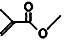 的物质的分子式为C5H8O2;
的物质的分子式为C5H8O2; 的一氯代物有5种;
的一氯代物有5种;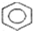 -CH2-C≡CCH2-CH3,其中共平面的碳原子最多可能有15个.
-CH2-C≡CCH2-CH3,其中共平面的碳原子最多可能有15个.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com