
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向含有FeBr2的溶液中通入过量Cl2充分反应:2Fe2++4Br-+3Cl2═2Fe3++6Cl-+2Br2 | |
| B. | Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+H2O | |
| C. | 磁性氧化铁溶于稀硝酸:3 Fe2++4H ++NO3-═3Fe3++NO↑+3H2O | |
| D. | 明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:2Ba2++3OH-+Al3++2 SO42-═2BaSO4↓+Al(OH)3↓ |
查看答案和解析>>
科目: 来源: 题型:解答题
| 名称 | 氢氧化镁 | 银 | |
| 化学式 | HNO3 | Mg(OH)2 | |
| 类别 | 酸 | 单质 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:实验题
 某化学小组设计如图装置,探究铜和一定量的浓HNO3是否反应是否有NO生成.已知:A试管内空气体积为50mL(标准状况),B广口瓶盛80mL水,硝酸不溶于煤油.
某化学小组设计如图装置,探究铜和一定量的浓HNO3是否反应是否有NO生成.已知:A试管内空气体积为50mL(标准状况),B广口瓶盛80mL水,硝酸不溶于煤油.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 加入过量的Ba(OH)2溶液时:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| B. | 溶液恰好呈中性时:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| C. | SO42-离子恰好完全沉淀时:Al3++SO42-+Ba2++4OH-═AlO2-+BaSO4↓+2H2O | |
| D. | 明矾与Ba(OH)2按物质的量比1:1反应时:Al3++SO42-+Ba2++3OH-═Al(OH)3↓+BaSO4↓ |
查看答案和解析>>
科目: 来源: 题型:解答题
| 溶质的物质的量浓度/mol•L-1 | 溶液的密度/g•cm-3 | 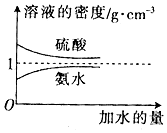 | |
| 硫酸 | c1 | ρ1 | |
| 氨水 | c2 | ρ2 |
查看答案和解析>>
科目: 来源: 题型:实验题
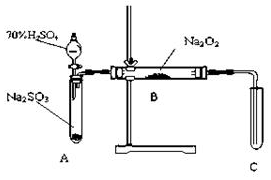 化学兴趣小组同学运用类比学习的思想,探究过氧化钠与二氧化硫的反应.小组同学改进了如图所示的装置进行实验制取SO2的反应.充分反应,B中固体由淡黄色变为白色(Na2O2完全反应),将带火星的木条插入试管C中,木条复燃.试回答下列问题:
化学兴趣小组同学运用类比学习的思想,探究过氧化钠与二氧化硫的反应.小组同学改进了如图所示的装置进行实验制取SO2的反应.充分反应,B中固体由淡黄色变为白色(Na2O2完全反应),将带火星的木条插入试管C中,木条复燃.试回答下列问题:| 实验操作 | 预期现象与结论 |
| 步骤1:取少量白色固体于试管,加入过量3mol•L-1的稀盐酸,塞上单孔胶塞,将生成的气体通入品红溶液. | 若有能使品红溶液褪色的无色气体生成,说明白色固体含有Na2SO3,则假设1或3成立,若无该现象,则假设2成立. |
| 步骤2:在步骤1反应后的溶液加入1mol•L-1BaCl2溶液. | 若有白色沉淀生成,则说明白色固体含Na2SO4. 结合步骤1的结论,则假设3成立,若无该现象,则假设1成立. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com