
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
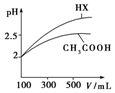 25℃时部分弱电解质的电离平衡常数数据如表所示:
25℃时部分弱电解质的电离平衡常数数据如表所示:| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 制造炊具 | B. | 制儿童玩具油漆 | C. | 制牙膏皮 | D. | 炼铝厂制造铝锭 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 酒精灯在桌上歪倒失火后,立即用湿布盖灭 | |
| B. | 灭火,也用黄沙扑灭 | |
| C. | 如果苯酚溶液沾到皮肤上,应立即用酒精洗 | |
| D. | 不慎将酸溅到眼中,应立即用干布擦去 |
查看答案和解析>>
科目: 来源: 题型:实验题
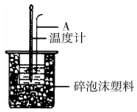 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下: | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 25.0 | 25.2 | 28.5 | ||
| 2 | 24.9 | 25.1 | 28.3 | ||
| 3 | 25.5 | 26.5 | 31.8 | ||
| 4 | 25.6 | 25.4 | 29.0 | ||
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com