
科目: 来源: 题型:选择题
| A. | 属于酯类的有4种 | |
| B. | 属于羧酸的有2种 | |
| C. | 存在有能使溴的四氯化碳溶液褪色的同分异构体 | |
| D. | 存在分子中含有五元环的酯类化合物 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 8种 | B. | 9种 | C. | 10种 | D. | 11种 |
查看答案和解析>>
科目: 来源: 题型:选择题
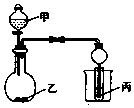 用如图装置进行实验,将少量液体甲逐滴加入到固体乙中,试管中试剂为丙,则下表中对应选项正确的是 ( )
用如图装置进行实验,将少量液体甲逐滴加入到固体乙中,试管中试剂为丙,则下表中对应选项正确的是 ( ) | 甲 | 乙 | 丙 | 试管中的现象 | |
| A | 浓硫酸 | 亚硫酸钠 | 石蕊试液 | 先变红后褪色 |
| B | 浓硝酸 | 铜 | KI-淀粉溶液 | 溶液变蓝色 |
| C | 醋酸 | 粉末状贝壳 | BaCl2溶液 | 变浑浊 |
| D | 浓氨水 | 生石灰 | FeCl2溶液 | 最后生成白色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 含有NA个氦原子的氦气的物质的量为2摩尔 | |
| B. | 2摩尔水的摩尔质量是1摩尔水的摩尔质量的2倍 | |
| C. | 25℃,1.01×105Pa,64g的SO2中含有的原子数为3NA | |
| D. | 1摩尔任何物质所含的分子数均为NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | $\frac{Vd}{MN+2240}$ | B. | $\frac{1000Vd}{MN-2240}$ | C. | $\frac{1000VdM}{MN+2240}$ | D. | $\frac{MN}{22.4(V+0.1)d}$ |
查看答案和解析>>
科目: 来源: 题型:选择题
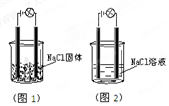 一化学兴趣小组在家中进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是( )
一化学兴趣小组在家中进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是( )| A. | NaCl是非电解质 | B. | NaCl溶液是电解质 | ||
| C. | NaCl在水溶液中离子键发生断裂 | D. | NaCl溶液中水电离出大量的离子 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 转移溶液后未洗涤烧杯和玻璃棒就直接定容 | |
| B. | 称量时左码右物 | |
| C. | 定容后把容量瓶倒转摇匀,发现液面低于刻度,再滴加几滴水至刻度线 | |
| D. | 在容量瓶中进行定容时俯视刻度线 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 打开啤酒盖,立即有气体逸出 | |
| B. | 新制的氯水在光照条件下颜色变浅 | |
| C. | NO2和N2O4的混合体系,压缩容器体积,颜色变深 | |
| D. | 工业生产硫酸的过程中使用过量的O2,以提高SO2的转化率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com