
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:选择题
| X | Y | W | |
| n(起始状态)/mol | 2 | 1 | 0 |
| n(平衡状态)/mol | 1 | 0.5 | 1.5 |
| A. | 此反应的平衡常数表达式是K=$\frac{{c}^{2}(X)•c(Y)}{{c}^{3}(W)}$ | |
| B. | 达到平衡后,升高温度,W的体积分数减少,则此反应的△H>0 | |
| C. | 达到平衡后,增大压强,正、逆反应速率均增大,平衡向正反应方向移动 | |
| D. | 达到平衡后,将容器体积压缩为2L,W的物质的量浓度变为0.75mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
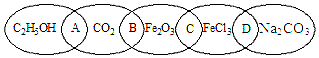
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氢气的燃烧热为285.5 kJ•mol-1,则水分解的热化学方程式为2H2O(l)═2H2(g)+O2(g)△H=+285.5 kJ•mol-1 | |
| B. | 已知2C(石墨,s)+O2(g)═2CO(g)△H=-221 kJ•mol-1,则石墨的燃烧热为 110.5 kJ•mol-1 | |
| C. | 已知N2(g)+3H2(g)?2NH3(g)△H=-92.4 kJ•mol-1,则在一定条件下将1 mol N2和3 mol H2置于一密闭容器中充分反应后最多可放出92.4 kJ的热量 | |
| D. | 已知乙醇和乙烯的燃烧热分别为1 366.8 kJ•mol-1和1 411.0 kJ•mol-1,则乙烯水化制乙醇的热化学方程式为C2H4(g)+H2O(l)═C2H5OH(l)△H=-44.2 kJ•mol-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 46g NO2和N2O4的混合气体中含有的原子个数为3NA | |
| B. | 1 mol Na2O2与水完全反应时转移电子数为2NA | |
| C. | 标准状况下,2.24L庚烷含有的分子数为0.1NA | |
| D. | 1 mol Na2O2中含有的阴离子数为0.2NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 无法计算 | B. | 2.8g | C. | 5.6g | D. | 11.2g |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1mol/L | B. | 2 mol/L | C. | 0.5 mol/L | D. | 1.5 mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com