
科目: 来源: 题型:选择题
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A. | 反应前3min的平均速率v(Z)=2.0×10-5 mol/(L•min) | |
| B. | 其他条件不变,降低温度,反应达到新平衡前v(正)>v(逆) | |
| C. | 升高温度,该反应的平衡常数将增大 | |
| D. | 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大 |
查看答案和解析>>
科目: 来源: 题型:实验题
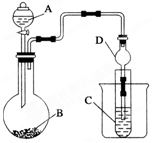 为探究元素的非金属性的变化规律,某化学兴趣小组同学设计了如下一系列实验,利用如图所示装置:
为探究元素的非金属性的变化规律,某化学兴趣小组同学设计了如下一系列实验,利用如图所示装置:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 由上述反应可知,ClO-的氧化性强于FeO42- | |
| B. | 高铁酸钾中铁显+6价 | |
| C. | 上述反应中氧化剂和还原剂的物质的量之比为2:3 | |
| D. | K2FeO4处理水时,不仅能消毒杀菌,而且生成的Fe3+水解形成Fe(OH)3胶体能吸附水中的悬浮杂质 |
查看答案和解析>>
科目: 来源: 题型:推断题
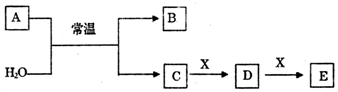
 .
.查看答案和解析>>
科目: 来源: 题型:实验题
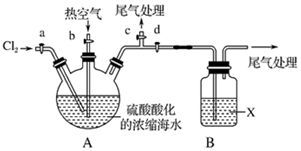
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:实验题
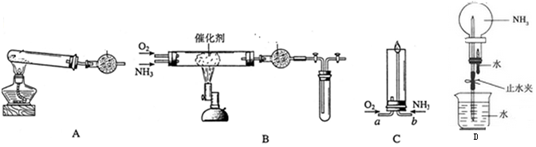
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 蒸馏法是海水谈化的方法之一 | |
| B. | 海水中的${\;}_{92}^{235}$U元素经浓缩提炼后可作核反应堆燃料 | |
| C. | 海水中的Li元素属于微量元素,提炼后可作Li电池原料 | |
| D. | 0℃以上,温度越高,水的密度越小 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1:1:2 | B. | 1:4:1 | C. | 4:4:1 | D. | 4:2:1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1.0×10-7 mol/L | B. | 1.0×107 mol/L | C. | $\frac{0.1}{a}$mol/L | D. | $\frac{0.1b}{a+b}$mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com