
科目: 来源: 题型:实验题
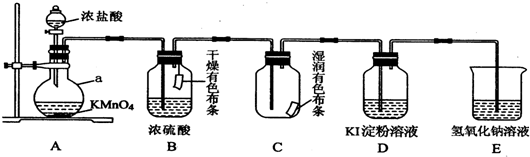
查看答案和解析>>
科目: 来源: 题型:填空题
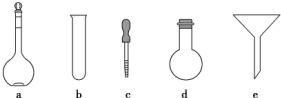
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Al溶于某强酸失去2mol电子,一定产生2gH2 | |
| B. | 0.1mol肼(N2H4)中共用电子对教目为0.5NA | |
| C. | 64.0gSO2与足量O2生成SO3电子转移教为2NA | |
| D. | 2L0.5mol/L硫酸钾溶液阴离子电荷数为2NA |
查看答案和解析>>
科目: 来源: 题型:填空题
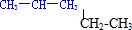 ⑥氕、氘和氚
⑥氕、氘和氚查看答案和解析>>
科目: 来源: 题型:实验题
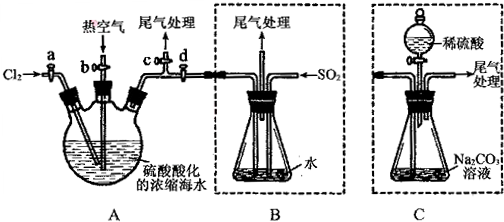
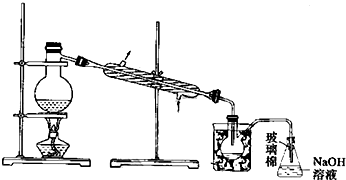
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 温度升高,Na2CO3溶液的Ksp和c(OH-)均会增大 | |
| B. | 沉淀转化的离子方程式为CO32-(aq)+CaSO4(s)?CaCO3(s)+SO42-(aq) | |
| C. | 该条件下,CaCO3的溶解度约为1×10-3g | |
| D. | CaCO3和CaSO4共存的悬浊液中,$\frac{c(S{{O}_{4}}^{2-})}{c(C{{O}_{3}}^{2-})}$=9×104 |
查看答案和解析>>
科目: 来源: 题型:解答题
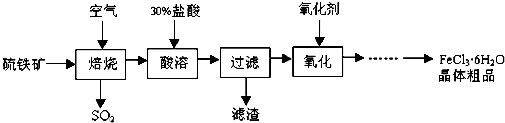
查看答案和解析>>
科目: 来源: 题型:解答题
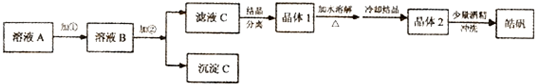
| 开始沉淀 | 沉淀完全 | |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Zn(OH)2 | 5.7 | 8.0 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.0008mol/L | B. | 0.00125mol/L | C. | 0.8mol/L | D. | 1.25mo/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com