
科目: 来源: 题型:选择题
| A. | 苯与液溴在FeBr3催化作用下生成溴苯的反应 | |
| B. | 丙烯和氯气在一定条件下反应生成ClCH2CH=CH2 | |
| C. | 乙酸与乙醇生成乙酸乙酯的反应 | |
| D. | 乙烯与HCl气体反应生成一氯乙烷的反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氧化铝熔点很高,可用作耐火材料 | |
| B. | 铝热反应原理是炼铁最常用的反应原理 | |
| C. | 过氧化钠可以用作呼吸面具中的供氧剂 | |
| D. | 青铜是我国使用最早的合金 |
查看答案和解析>>
科目: 来源: 题型:解答题
 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用纯碱溶液溶解苯酚:CO32-+C6H5OH→C6H5O-+HCO3- | |
| B. | 用强碱溶液吸收工业制取硝酸尾气NO+NO2+2OH-=2NO3-+H2O | |
| C. | 用二氧化锰和浓盐酸反应制氯气:MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl-+Cl2↑+2H2O | |
| D. | 向AlCl3溶液中滴加过量的氨水:Al3++4NH3•H2O=AlO2-+2H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 固体的溶解过程与焓变有关 | |
| B. | 温度、压强一定时,放热的熵增加反应不一定能自发进行 | |
| C. | 反应焓变是决定反应能否自发进行的唯一因素 | |
| D. | 在温度、压强一定的条件下,焓因素和熵因素共同决定一个化学反应的方向 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 容器编号 | 起始时各物质物质的量/mol | 达到平衡时体系能量的变化 | ||
| N2 | H2 | NH3 | ||
| (1) | 2 | 3 | 0 | 27.78kJ |
| (2) | 1.6 | 1.8 | 0.8 | Q |
| A. | 容器(2)中反应开始时v(正)>v(逆) | |
| B. | 容器(1)、(2)中反应达平衡时压强相等 | |
| C. | 容器(2)中反应达平衡时,吸收的热量Q为9.26 kJ | |
| D. | 若条件为“绝热恒容”,容器(1)中反应达平衡时n (NH3)<0.6 mol |
查看答案和解析>>
科目: 来源: 题型:选择题
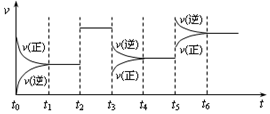
| A. | t2时增加了X的浓度 | B. | t3时增大了压强 | ||
| C. | t5时升高了温度 | D. | t4~t5时间内转化率最大 |
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:解答题
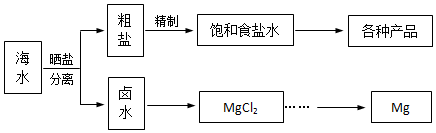
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1.96% | B. | 5.66% | C. | 75% | D. | 12.5% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com