
科目: 来源: 题型:解答题
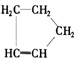 是环戊烯的结构简式,可进一步简写为
是环戊烯的结构简式,可进一步简写为 .环戊烯的化学性质跟烯烃相似.
.环戊烯的化学性质跟烯烃相似.
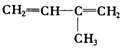 )臭氧分解各种产物的结构简式及物质的量之比:HCHO、
)臭氧分解各种产物的结构简式及物质的量之比:HCHO、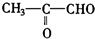 ;2:1.
;2:1. )合成乙二醛(
)合成乙二醛(  )的各步合成路线流程.
)的各步合成路线流程.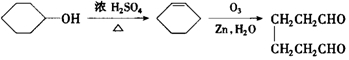 .
.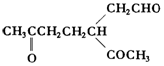 .A经催化加氢得产物B,B的分子式是C10H20.分析数据表明,分子B内含有六元碳环.请写出A和B的结构简式(不必注明名称).
.A经催化加氢得产物B,B的分子式是C10H20.分析数据表明,分子B内含有六元碳环.请写出A和B的结构简式(不必注明名称). ,B是
,B是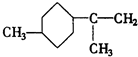 .
.查看答案和解析>>
科目: 来源: 题型:实验题
 某化学课外活动小组的同学利用原电池原理探究一定温度下(实验时实际的环境温度)使铁钝化的硝酸的最低浓度.
某化学课外活动小组的同学利用原电池原理探究一定温度下(实验时实际的环境温度)使铁钝化的硝酸的最低浓度.| 实验次数 | 实验温度(℃) | 注入水的体积(mL) |
| 1 | 17.2 | 2.4 |
| 2 | T1 | 2.5 |
| 3 | T2 | 2.3 |
查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:实验题
 实验需要0.80mol•L-1 NaOH溶液475mL和0.40mol•L-1硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:
实验需要0.80mol•L-1 NaOH溶液475mL和0.40mol•L-1硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温下pH=7的溶液中:Fe3+、Mg2+、SO42-、Cl-能大最共存 | |
| B. | 在含有0.1mol/L Fe3+的溶液中:SCN-、Cl-、K+不能大最共存 | |
| C. | 在含有HCO3-、SO32-、S2-、CH3COO-四种阴离子的溶液中加入足量的Na2O2固体后,CH3COO-变化最小 | |
| D. | NaHSO4溶液与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
查看答案和解析>>
科目: 来源: 题型:推断题
 A、B、C、D、E、X均为中学化学常见物质,其中A、B、C、D、E是由短周期元素组成的无机物,它们存在如图转化关系(部分生成物和反应条件略去).请回答下列问题:
A、B、C、D、E、X均为中学化学常见物质,其中A、B、C、D、E是由短周期元素组成的无机物,它们存在如图转化关系(部分生成物和反应条件略去).请回答下列问题: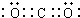 ; B与X反应生成C的离子方程式2OH-+CO2=CO32-+H2O;
; B与X反应生成C的离子方程式2OH-+CO2=CO32-+H2O;查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com