
科目: 来源: 题型:实验题
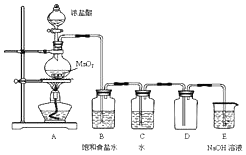 某化学兴趣小组制备饱和氯水并对饱和氯水与碳酸钙的反应进行研究.
某化学兴趣小组制备饱和氯水并对饱和氯水与碳酸钙的反应进行研究.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
 某条件下,在2L密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.下列有关说法不正确的是( )
某条件下,在2L密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.下列有关说法不正确的是( )| A. | 反应2min末X的浓度为0.35mol/L | |
| B. | 该反应的化学方程式可表示为:2Z?2Y+3X | |
| C. | 反应2min内以Z浓度变化表示的平均反应速率为0.05mol/(L•min) | |
| D. | 任何时刻以Z、Y浓度变化表示的反应速率关系符合υ(Z)=υ(Y) |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:实验题
 巴蜀化学课外小组用海带为原料制取了少量碘水,现用CCl4 (沸点76.8℃)从碘水中萃取碘并用分液漏斗分离两种溶液.实验操作可分解为如下几步:
巴蜀化学课外小组用海带为原料制取了少量碘水,现用CCl4 (沸点76.8℃)从碘水中萃取碘并用分液漏斗分离两种溶液.实验操作可分解为如下几步:
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:实验题
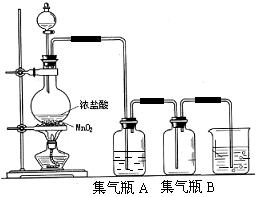 实验室中所用少量氯气是用下列方法制取的,4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+MnCl2+2H2O
实验室中所用少量氯气是用下列方法制取的,4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+MnCl2+2H2O查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com