
科目: 来源: 题型:推断题
 .
.查看答案和解析>>
科目: 来源: 题型:解答题
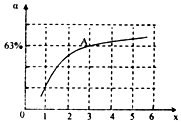 肼(N2H4)和氨是氮的两种常见化合物,在科学技术和生产中有广泛应用.回答下列问题:
肼(N2H4)和氨是氮的两种常见化合物,在科学技术和生产中有广泛应用.回答下列问题: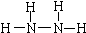 .
.| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
| n(N2) | n(H2) | n(NH3) | |
| 甲 | 1mol | 3mol | 0mol |
| 乙 | 0.5mol | 1.5mol | 1mol |
| 丙 | 0mol | 0mol | 4mol |
查看答案和解析>>
科目: 来源: 题型:选择题
| A | B | C | D |
 |  |  | 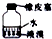 |
| 用Cl2氧化溶液中的Br- | 分离有机层和水层 | 高温结束后先 停止加热后停止通水 | 贮存液溴 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题
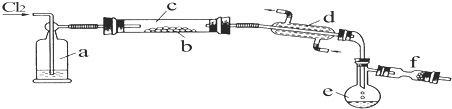
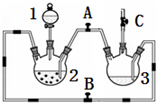 某化学兴趣小组拟用图装置制备氢氧化亚铁并观察其颜色.提供化学药品:铁粉、稀硫酸、氢氧化钠溶液.
某化学兴趣小组拟用图装置制备氢氧化亚铁并观察其颜色.提供化学药品:铁粉、稀硫酸、氢氧化钠溶液.| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
查看答案和解析>>
科目: 来源: 题型:填空题
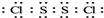 .
.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
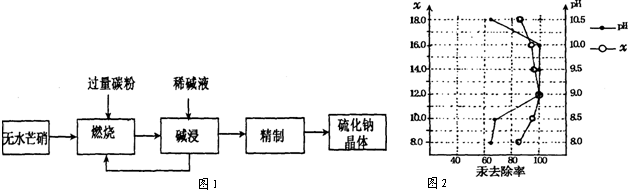
查看答案和解析>>
科目: 来源: 题型:选择题
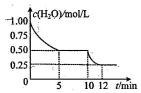 在2L密闭容器中进行反应C(s)+H2O(g)?CO(g)+H2(g)△H>0,测得c(H2O)随反应时间(t)的变化如图.下列判断正确是( )
在2L密闭容器中进行反应C(s)+H2O(g)?CO(g)+H2(g)△H>0,测得c(H2O)随反应时间(t)的变化如图.下列判断正确是( )| A. | 0~5min内,v(H2)=0.05mol/(L•min) | |
| B. | 5min时该反应的K值一定小于12min时的K值 | |
| C. | 10min时,改变的外界条件可能是减小压强 | |
| D. | 5min时该反应的v(正)大于11min时的v(逆) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质 | |
| B. | 生活中常见金属镁、铝、铁、铜等均能通过热还原法冶炼 | |
| C. | 胶体具有介稳性,是因为同种胶体粒子的运动有规律,即布朗运动 | |
| D. | 由于2NO+2CO?2CO2+N2的△H<0,则该反应一定能自发进行 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 硅胶可防止食物受潮是由于其具有吸水性 | |
| B. | 持续加热到一定温度能杀死甲型H1N1流感病毒是因为病毒蛋白质受热变性 | |
| C. | 纤维素在人体内可水解为葡萄糖是人类重要的营养物质之一 | |
| D. | 酸性重铬酸钾用于检查酒驾是利用其强氧化性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com