
科目: 来源: 题型:选择题
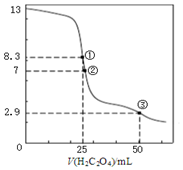 25℃时,用0.0500mol•L-1H2C2O4(二元弱酸)溶液滴定25.00mL0.1000mol•L-1NaOH溶液所得滴定曲线如图.下列说法不正确的是( )
25℃时,用0.0500mol•L-1H2C2O4(二元弱酸)溶液滴定25.00mL0.1000mol•L-1NaOH溶液所得滴定曲线如图.下列说法不正确的是( )| A. | 点①所示溶液中:c(H+)+2c(H2C2O4)+c(HC2O4-)=c(OH-) | |
| B. | 点②所示溶液中:c(HC2O4-)+2c(C2O42-)=0.0500mol•L-1 | |
| C. | 点③所示溶液中:c(Na+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4) | |
| D. | 滴定过程中可能出现:c(Na+)>c(C2O42-)=c(HC2O4-)>c(H+)>c(OH-) |
查看答案和解析>>
科目: 来源: 题型:实验题
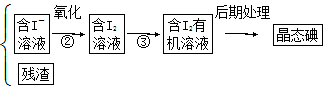
查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:解答题
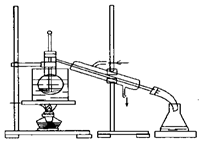
 某化学兴趣小组用如图所示装置电解CuSO4溶液,测定铜的相对原子质量.
某化学兴趣小组用如图所示装置电解CuSO4溶液,测定铜的相对原子质量.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 16:25 | B. | 1:7 | C. | 1:6 | D. | 2:11 |
查看答案和解析>>
科目: 来源: 题型:推断题
 ,请完成下列空白:
,请完成下列空白:查看答案和解析>>
科目: 来源: 题型:解答题
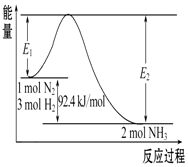 科学家一直致力于“人工固氮”的方法研究.
科学家一直致力于“人工固氮”的方法研究.| t℃ | 473 | 573 | 673 | … |
| K | 4.4×10-2 | K1 | K2 | … |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 Ⅰ红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).根据图回答下列问题:
Ⅰ红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).根据图回答下列问题:查看答案和解析>>
科目: 来源: 题型:推断题
 A元素最简单的氢化物的电子式为
A元素最简单的氢化物的电子式为 .
. ,已知断裂1mol B-B键吸收167kJ的热量,生成1mol B≡B键放出942kJ热量.写出B4转化为B2的热化学方程式:N4(g)=2N2(g)△H=-882kJ•mol-1;
,已知断裂1mol B-B键吸收167kJ的热量,生成1mol B≡B键放出942kJ热量.写出B4转化为B2的热化学方程式:N4(g)=2N2(g)△H=-882kJ•mol-1;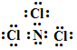 ;X遇水蒸气可形成一种常见的漂白性物质.则X与水反应的化学方程式是NCl3+3H2O=NH3↑+3HClO.
;X遇水蒸气可形成一种常见的漂白性物质.则X与水反应的化学方程式是NCl3+3H2O=NH3↑+3HClO.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com