
科目: 来源: 题型:解答题
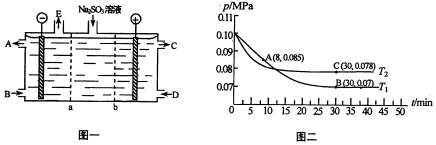
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:实验题
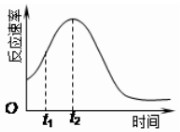 某化学兴趣小组在一次实验探究中发现,向草酸溶液中逐滴加入酸性高锰酸钾溶液时,发现反应速率变化如图所示,小组成员探究t1~t2时间内速率变快的主要原因,为此“异常”现象展开讨论,猜想造成这种现象的最可能原因有两种.
某化学兴趣小组在一次实验探究中发现,向草酸溶液中逐滴加入酸性高锰酸钾溶液时,发现反应速率变化如图所示,小组成员探究t1~t2时间内速率变快的主要原因,为此“异常”现象展开讨论,猜想造成这种现象的最可能原因有两种.| 试管A | 试管B | |
| 加入试剂 | 2mL0.1mol/L H2C2O4溶液、1mL 0.05mol/L 酸性KMnO4 | 2mL0.1mol/L H2C2O4溶液、1mL 0.05mol/L 酸性KMnO4,少量MnSO4(s)固体(填物质名称) |
| 实验现象(褪色时间) | 褪色时间10min | 褪色时间<10min(选填“<”“>”或“=”) |
| 结论 | 猜想Ⅱ正确 | |
查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:实验题
| 物理量 | V(0.20mol/H2 | V(蒸馏水)/mL | V(0.010mol/L KMnO4溶液)/mL | T/℃ | 乙 |
| ① | 2.0 | 0 | 4.0 | 50 | |
| ② | 2.0 | 0 | 4.0 | 25 | |
| ③ | 1.0 | a | 4.0 | 25 |
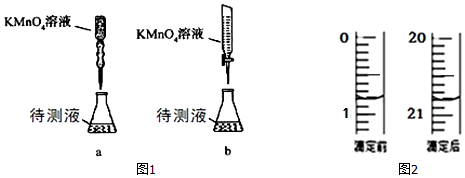
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com