
科目: 来源: 题型:多选题
| A. | 产生氯气1.792L | B. | 生成AgCl沉淀11.7g | ||
| C. | 被还原的HCl为0.16mol | D. | 转移的电子数为0.16个 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 肯定不含I- | B. | 可能不含Cu2+ | C. | 可能含有SO32- | D. | 以上结论都不对 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 醋酸溶液的pH大于盐酸 | |
| B. | 醋酸溶液的pH小于盐酸 | |
| C. | 分别用水稀释相同倍数后,所得溶液中:c(Cl-)═c(CH3COO-) | |
| D. | 两种溶液中水的电离程度相同 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | K+、CO32、AlO2- | B. | SO42-、AlO2-、K+、CO32-、 | ||
| C. | CO32-、K+、Al3+ | D. | MnO4-、K+、CO32-、NH4+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 某密闭容器中盛有0.2molSO2和0.1molO2,一定条件下充分反应,生成SO3分子数为0.2NA | |
| B. | 一定条件下,2.3gNa与O2完全反应生成3.6g产物时失去的电子数为0.1NA | |
| C. | 25℃时,0.1mol•L-1Na2S溶液中含有Na+的数目为0.2NA | |
| D. | 将1mL5.68mol•L-1的FeCl3饱和溶液制成胶体,可得到0.00568NA个Fe(OH)3胶体 |
查看答案和解析>>
科目: 来源: 题型:解答题
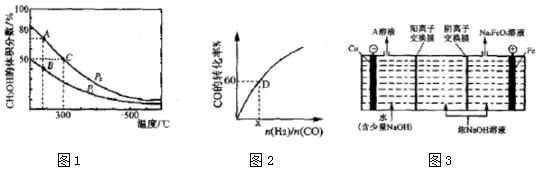
| 反应速率v | 平衡常数K | 平衡转化率α |
查看答案和解析>>
科目: 来源: 题型:实验题
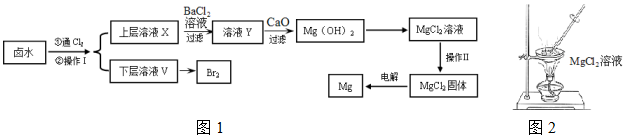
| 开始沉淀时 | 沉淀完全时 | |
| Mg2+ | pH=9.6 | pH=11.0 |
| Ca2+ | pH=12.2 | c(OH-)=1.8mol/L |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 制备无水AlCl3时,加入的SOCl2只起脱水剂作用 | |
| B. | 电池工作过程中,SOCl2被还原为Li2SO3和S单质 | |
| C. | 电池工作过程中,电子经电解质溶液流向锂电极 | |
| D. | 用该电池电解水,生成2mol H2,消耗1.5molSOCl2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 当a=b时,发生的离子总反应为:2OH-+CO2+Ba2+═BaCO3↓+H2O | |
| B. | 当3a=2b时,发生的离子总反应为:6OH-+3CO2+2Ba2+═2BaCO3↓+3H2O+CO32- | |
| C. | 当$\frac{3}{2}$a<b<3a时,溶液中含有n(CO32-):n(HCO3-)=(3a-b):(2b-3a) | |
| D. | 当3a=b时,溶液中Na+、Ba2+与HCO3-的物质的量之比为1:1:3 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com