
科目: 来源: 题型:选择题
| 序号 | ① | ② | ③ | ④ |
| 溶液 | NaCl | CH3COONH4 | NaHCO3 | 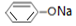 |
| pH | 7.0 | 7.0 | 8.4 | 9.9 |
| A. | 酸性:H2CO3>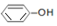 | |
| B. | 水电离产生的c(H+):①=② | |
| C. | 溶液③中:c(HCO3-)+c(CO32-)+c(H2CO3)=0.1mol•L-1 | |
| D. | 溶液④中:c(Na+)>c(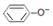 )>c(OH-)>c(H+) )>c(OH-)>c(H+) |
查看答案和解析>>
科目: 来源: 题型:选择题
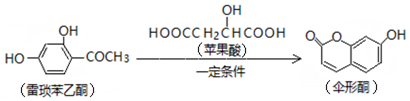
| A. | 一分子雷琐苯乙酮含有3个碳碳双键 | |
| B. | 苹果酸的一种缩聚产物是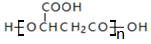 | |
| C. | 1mol伞形酮与足量NaOH溶液反应,最多可消耗2mol NaOH | |
| D. | 雷琐苯乙酮、苹果酸、伞形酮都能跟FeCl3溶液发生显色反应 |
查看答案和解析>>
科目: 来源: 题型:解答题
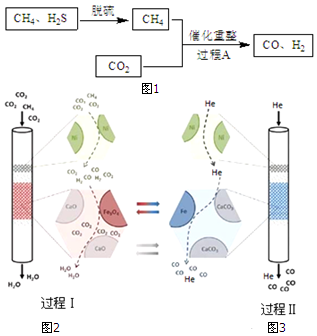
| 编号 | 催化剂 | 是否添加CaO | 还原产物 |
| 1 | Fe3O4 | 添加 | 有Fe |
| 2 | Fe3O4 | 不添加 | 无Fe |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验事实 | 解释 |
| A | 加热蒸干MgSO4溶液能得到MgSO4固体;加热蒸干MgCl2溶液得不到MgCl2固体 | H2SO4不易挥发,HCl易挥发 |
| B | 电解CuCl2溶液,阴极得到Cu;电解NaCl溶液,阴极得不到Na | 得电子能力:Cu2+>Na+>H+ |
| C | 浓HNO3能氧化NO;稀HNO3不能氧化NO | HNO3浓度越大,氧化性越强 |
| D | 钠与乙醇反应平缓;钠与水反应剧烈 | 羟基中氢的活性:C2H5OH<H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题
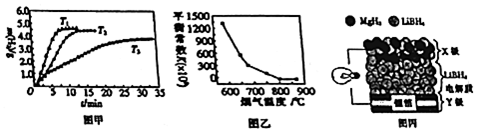
查看答案和解析>>
科目: 来源: 题型:解答题
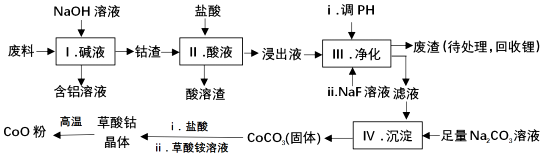
| Fe3+ | Co2+ | Co3+ | Al3+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
| 温度范围/℃ | 固体质量/g |
| 150~210 | 4.41 |
| 290~320 | 2.41 |
| 890~920 | 2.25 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 简单离子半径:Z>W>Y | |
| B. | 气态氢化物的稳定性:Z<W | |
| C. | Z的氢化物能与其最高价氧化物对应的水化物反应 | |
| D. | 在X2和W2构成的燃料电池中,W2作负极 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | C3H6Cl2有4种同分异构体 | |
| B. | 1,4-二甲基苯也称为间二甲苯 | |
| C. | 乙烯使溴水和高锰酸钾溶液褪色的原理相同 | |
| D. | 煤的干馏和石油的分馏均为物理变化 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 陶瓷是硅酸盐产品 | B. | 葡萄糖可用于制镜业 | ||
| C. | 纸的主要成分为纤维素 | D. | 汉白玉的主要成分碳酸钙属于碱类 |
查看答案和解析>>
科目: 来源: 题型:解答题
 氮及其化合物在工农业生产中具有重要作用.完成下列填空:
氮及其化合物在工农业生产中具有重要作用.完成下列填空:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com