
科目: 来源: 题型:选择题
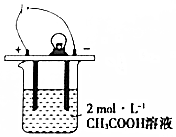 如图所示,烧杯中的溶液为2mol•L-1CH3COOH溶液,接通直流电源,分别向烧杯中加入下列物质(保持反应温度不变),灯泡变暗的是( )
如图所示,烧杯中的溶液为2mol•L-1CH3COOH溶液,接通直流电源,分别向烧杯中加入下列物质(保持反应温度不变),灯泡变暗的是( )| A. | 加入固体NaOH | B. | 加水稀释 | C. | 加入金属Na | D. | 通入HC1气体 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 上述转化属于分解反应 | B. | 上述反应过程放出大量热 | ||
| C. | 生成的CaO可作氯气的干燥剂 | D. | CaCO3水泥的主要成分之一. |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
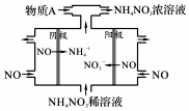 NO2是形成雾霾天气的原因之一.
NO2是形成雾霾天气的原因之一.查看答案和解析>>
科目: 来源: 题型:解答题
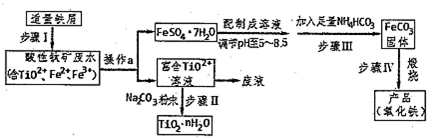
查看答案和解析>>
科目: 来源: 题型:推断题
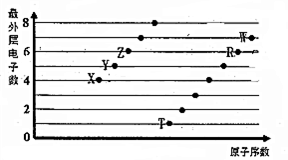 部分短周期元素原子最外层电子数与原子序数的关系如图,回答下列问题:
部分短周期元素原子最外层电子数与原子序数的关系如图,回答下列问题: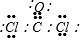 ;已知1mol XZW2与4mol NaOH
;已知1mol XZW2与4mol NaOH查看答案和解析>>
科目: 来源: 题型:选择题
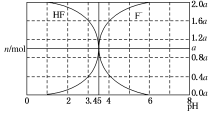 25℃时,用 2a mol•L-1 NaOH 溶液滴定 1.0L 2a mol•L-1氢氟酸溶液,得到混合液中 HF、F-的物质的量与溶液 pH 的变化如图所示.下列说法正确的是( )
25℃时,用 2a mol•L-1 NaOH 溶液滴定 1.0L 2a mol•L-1氢氟酸溶液,得到混合液中 HF、F-的物质的量与溶液 pH 的变化如图所示.下列说法正确的是( )| A. | pH=3 时,溶液中:c(Na+)>c(F-) | |
| B. | c(F-)>c(HF)时,溶液一定呈碱性 | |
| C. | pH=4 时,溶液中:c(HF)+c(Na+)+c(H+)-c(OH-)<2a mol?L-1 | |
| D. | pH=3.45 时,NaOH 溶液恰好与 HF 完全反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 稀醋酸中加入少量醋酸钠能增大醋酸的电离程度 | |
| B. | 25℃时,等体积等浓度的硝酸与氨水混合后,溶液pH=7 | |
| C. | 50℃时,NH4Cl和HCl的混合液中:c(NH4+)+c(H+)=c(OH-)+c(Cl-) | |
| D. | 0.1molAgCl和0.1molAgI混合后加入1L水中,所得溶液中c(Cl-)=c(I-) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | a=+90.3 | |
| B. | 恒温恒压下,在已达平衡的反应I体系中再充入少量He时平衡正向移动 | |
| C. | 其他条件不变,加压对反应Ⅱ的反应速率无影响 | |
| D. | 其他条件不变,升高温度可提高反应Ⅲ中CO2的转化率 |
查看答案和解析>>
科目: 来源: 题型:选择题
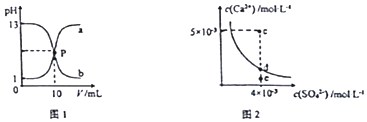
| A. | 图1中P点溶液:c(Na+ )=c(Cl-)>c(H+ )=c(OH- ) | |
| B. | 由图1可知盐酸和NaOH溶液的浓度均为1mol•L-1 | |
| C. | 图2中c点有沉淀生成,达平衡后溶液中c(SO42- )=3×10-3 mol•L-1 | |
| D. | 可通过蒸发将图 2中e点的溶液变到d点 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com