
科目: 来源: 题型:解答题
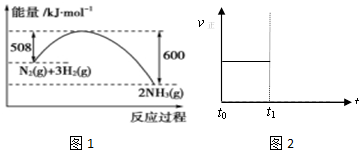
查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:多选题
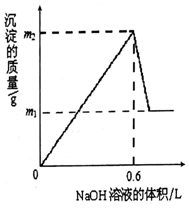 将m1g铜铝合金投入到1LH2SO4和HNO3的混合溶液中,完全溶解后只生成VLNO气体(标准状况),向反应后的溶液中逐渐加入1mol/LNaOH溶液,生成沉淀的质量与所加NaOH溶液的体积的关系如图所示.下列说法中不正确的是( )
将m1g铜铝合金投入到1LH2SO4和HNO3的混合溶液中,完全溶解后只生成VLNO气体(标准状况),向反应后的溶液中逐渐加入1mol/LNaOH溶液,生成沉淀的质量与所加NaOH溶液的体积的关系如图所示.下列说法中不正确的是( )| A. | m1-m2═10.2 | B. | 2c(H2SO4)+c(HNO3)═0.8 mol•L-1 | ||
| C. | 原合金中铝的质量分数为34.7% | D. | V=2.24 |
查看答案和解析>>
科目: 来源: 题型:解答题
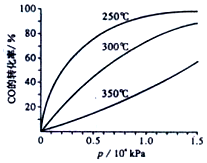 科研生产中常涉及碳的化合物.请回答下列问题:
科研生产中常涉及碳的化合物.请回答下列问题:| 反应时间/min | n[CO(g)]mol | n[H2O(g)]mol |
| 0 | 1.8 | 0.9 |
| t1 | 1.2 | |
| t2 | 0.3 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 反应②中反应物所具有的总能量大于生成物所具有的总能量 | |
| B. | 2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l)△H=-1135.7 kJ/mol | |
| C. | 铂作电极,KOH溶液作电解质溶液,由反应②设计的燃料电池,当电路中转移0.16mole-,生成N211.2g | |
| D. | 铂作电极,Na2SO4作电解质溶液,由反应②设计的燃料电池,工作一段时间后恢复至原温度,Na2SO4溶液的pH不变 |
查看答案和解析>>
科目: 来源: 题型:解答题
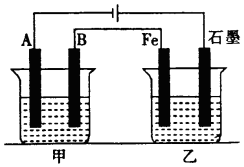 如图所示,甲、乙为相互串联的两电解池,甲池利用电解原理在铁上镀银,一段时间后,甲池阴极增重43.2g,乙中盛放足量的CuSO4溶液,请回答(1)~(3)小题:
如图所示,甲、乙为相互串联的两电解池,甲池利用电解原理在铁上镀银,一段时间后,甲池阴极增重43.2g,乙中盛放足量的CuSO4溶液,请回答(1)~(3)小题:查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:实验题
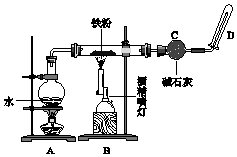 完成实验Fe与水蒸气反应,如图所示.
完成实验Fe与水蒸气反应,如图所示.查看答案和解析>>
科目: 来源: 题型:选择题
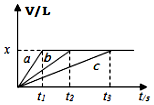 将等物质的量钠、镁、铝三种金属分别与200mL1mol•L-1的盐酸反应,测得生成的气体的体积V(已折合成标准状况的体积)与时间t的关系如图所示.下列说法正确的是( )
将等物质的量钠、镁、铝三种金属分别与200mL1mol•L-1的盐酸反应,测得生成的气体的体积V(已折合成标准状况的体积)与时间t的关系如图所示.下列说法正确的是( )| A. | x=44.8 | B. | 反应后的镁和铝均有剩余 | ||
| C. | 金属的物质的量可能均为0.1mol | D. | 曲线c表示钠与盐酸的反应 |
查看答案和解析>>
科目: 来源: 题型:实验题
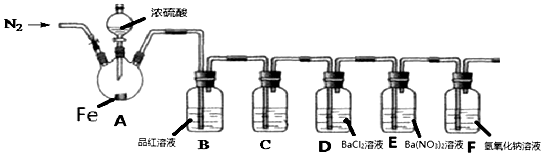
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com