
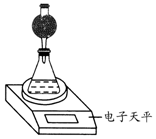
科目: 来源: 题型:实验题
| 实验编号 | T/℃ | 大理石规格 | HNO3浓度/mol•L-1 |
| ① | 常温 | 细颗粒 | 2.00 |
| ② | 常温 | 细颗粒 | 1.00 |
| ③ | 35℃ | 粗颗粒 | 2.00 |
| ④ | 35℃ | 细颗粒 | 2.00 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在常温常压下,2.8 g N2和CO的混合气体所含原子数为0.2 NA | |
| B. | 1 mol Cl2与足量Fe完全反应,转移3NA个电子 | |
| C. | 1 L 0.1 mol•L-1NaHCO3溶液中含有0.1 NA个HCO3- | |
| D. | 常温常压下,22.4L乙烯中C-H键数为4NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2.3 gNa+中含有NA个电子 | |
| B. | 硫酸的摩尔质量与硫酸分子的质量相等 | |
| C. | NA个CC14分子在标准状况下的体积约为22.4 L | |
| D. | 18 g H2O中含有NA个H2、NA个O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 配制0.1mol/LNaCl溶液,定容时不小心加水超过刻度线,立即将水吸出 | |
| B. | 实验室制取氧气并用排水法收集,出现倒吸现象,立即停止加热 | |
| C. | 少量浓硫酸沾在皮肤上,立即用大量水冲洗,并涂上稀NaOH溶液 | |
| D. | 使用分液漏斗萃取碘水中的碘,振荡过程中要适时打开活塞进行“放气” |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
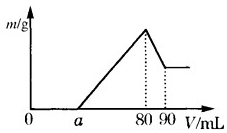 (1)把一定质量的镁、铝混合物投入到 2mol•L-1 的盐酸中,待金属完全溶解后,向溶液中加入 2mol•L-1 的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示.则:
(1)把一定质量的镁、铝混合物投入到 2mol•L-1 的盐酸中,待金属完全溶解后,向溶液中加入 2mol•L-1 的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示.则:查看答案和解析>>
科目: 来源: 题型:解答题
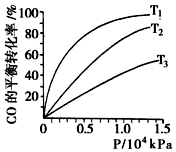 汽车尾气作为空气污染的主要来源之一,含有大量的有害物质,包括CO、
汽车尾气作为空气污染的主要来源之一,含有大量的有害物质,包括CO、| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O | ||
| Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 207 | 0.20 | 0.090 | 0.090 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | SO2(g)+NaOH(aq)═NaHSO3(aq)△H=-(2a-b)kJ/mol | |
| B. | SO2(g)+NaOH(aq)═NaHSO3(aq)△H=-(4b-a)kJ/mol | |
| C. | SO2(g)+NaOH(aq)═NaHSO3(aq)△H=-(a-4b)kJ/mol | |
| D. | SO2(g)+NaOH(aq)═NaHSO3(aq)△H=-(4a-b)kJ/mol |
查看答案和解析>>
科目: 来源: 题型:选择题
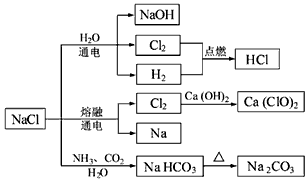
| A. | 石灰乳与Cl2的反应中,Cl2既作氧化剂,又作还原剂 | |
| B. | 25℃,NaHCO3在水中的溶解度比Na2CO3的大 | |
| C. | 图示的转化反应中有3个分解反应 | |
| D. | 图示的转化反应都是氧化还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com