
科目: 来源: 题型:选择题
| A. | 16gO2占有的体积约为11.2L | |
| B. | 22.4LH2含有阿伏加德罗常数个氢分子 | |
| C. | 在标准状况下,44.8LH2O的质量约为36g | |
| D. | 11gCO2与标准状况下5.6LHCl含有相同的分子数 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用分液漏斗分离水和四氯化碳的混合物时,四氯化碳从上口倒出 | |
| B. | 用玻璃棒搅拌漏斗中的液体以加快过滤速度 | |
| C. | 可以用酒精萃取碘水中的碘 | |
| D. | 海水通过蒸馏可制得淡水 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 反应中MnO2是氧化剂 | |
| B. | 氧化产物与还原产物物质的量之比为1:3 | |
| C. | KClO3在反应中失去电子 | |
| D. | 反应中每生成l mol K2MnO4,氧化剂得到2 mol电子 |
查看答案和解析>>
科目: 来源: 题型:推断题
 如图为A、B、C三种物质的溶解度曲线,据图回答下列问题:
如图为A、B、C三种物质的溶解度曲线,据图回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ①③④ | D. | ①②③ |
查看答案和解析>>
科目: 来源: 题型:实验题
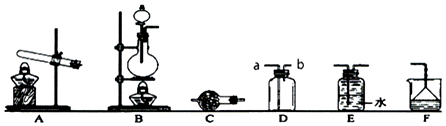
查看答案和解析>>
科目: 来源: 题型:填空题
 ;
; ;
;查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:解答题
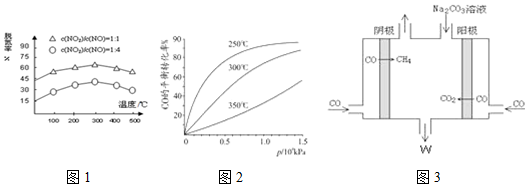
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com