
科目: 来源: 题型:选择题
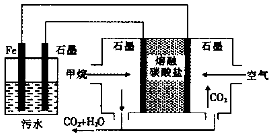
| A. | Fe电极的电极反应式为:Fe-2e-═Fe2+ | |
| B. | 通入空气的石墨电极的电极反应式为O2+2CO2+4e-═2CO32- | |
| C. | 通入甲烷的石墨电极的电极反应式为:CH4+100H+-8e-═CO32-+7H2O | |
| D. | 为增强污水的导电能力,可向污水中加入适量工业用食盐 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
 NaHNa+[:H]- CsOH
NaHNa+[:H]- CsOH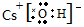 HSCN
HSCN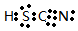 O22-
O22- .
.查看答案和解析>>
科目: 来源: 题型:推断题
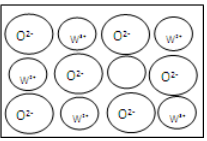 X、Y、Z、W四种元素原子序数依次增大且均小于36.Z基态原子最外层电子数是其内层电子总数的3倍,Y基态原子是同周期元素中未成对电子数最多的原子,X分别与Y、Z元素组合均可形成10电子微粒,W基态原子有10个价电子. 回答下列问题(以下问题均以推知元素符号作答):
X、Y、Z、W四种元素原子序数依次增大且均小于36.Z基态原子最外层电子数是其内层电子总数的3倍,Y基态原子是同周期元素中未成对电子数最多的原子,X分别与Y、Z元素组合均可形成10电子微粒,W基态原子有10个价电子. 回答下列问题(以下问题均以推知元素符号作答):查看答案和解析>>
科目: 来源: 题型:填空题
| 化合物 | NaF | MgF2 | MgO | SiF4 | SiO2 |
| 熔点/K | 1266 | 1534 | 3125 | 183 | 1983 |
| 摩氏硬度 | 3,2 | 6.0 | 6.5 | 7 |
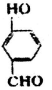 比
比 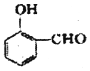 的沸点高(填“高”或“低”).
的沸点高(填“高”或“低”).查看答案和解析>>
科目: 来源: 题型:选择题
| 硼晶体的结构单元 | SF6分子 | S8分子 | NaCl | |
| 结构模型示意图 |  | 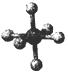 |  |  |
| 备注 | 熔点187K | 易溶于CS2 |
| A. | 单质硼属分子晶体,其结构单B12中含有30个B-B键,含20个正三角形 | |
| B. | SF6是由极性键构成的极性分子 | |
| C. | 固态硫S8属于原子晶体 | |
| D. | NaCl晶体中每个Na+周围距离最近的Na+有6个 |
查看答案和解析>>
科目: 来源: 题型:推断题
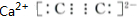 .
.
查看答案和解析>>
科目: 来源: 题型:填空题
| 35Cl | 34.969 | 75.77% | 35Cl | 35 | 75.77% |
| 37Cl | 36.969 | 24.23% | 37Cl | 37 | 24.23% |
| 平均 | 35.453 | 平均 | 35.485 | ||
查看答案和解析>>
科目: 来源: 题型:解答题
 按要求完成下列各题:
按要求完成下列各题:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原子半径:A<B<C | |
| B. | 三种元素的最高价氧化物对应水化物均可由化合反应得到 | |
| C. | A的氢化物稳定性小于C的氢化物稳定性 | |
| D. | B 和A的最高价氧化物可发生置换反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com