
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 使用蒸馏水 | B. | 使用NaHCO3溶液 | ||
| C. | 使用CuSO4和NaOH溶液 | D. | 使用pH试纸 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 松油醇的结构简式为 ,则其同分异构体可能属于醛类、酮类或芳醇类 ,则其同分异构体可能属于醛类、酮类或芳醇类 | |
| B. | 甲烷和氯气的反应与乙烯和Br2的反应属于同一类型的反应 | |
| C. | 分子式为C4H8O2且能与氢氧化钠溶液反应的有机物(不考虑立体异构和醛类物质)有6种 | |
| D. | 乙醇、乙酸均能与NaOH溶液反应,因为分子中均含有-OH |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的或结论 |
| A | 在少量无水乙醇中加入金属Na,缓慢生成可以在空气中燃烧的气体 | CH3CH2OH是弱电解质 |
| B | 将SO2气体通入紫色石蕊溶液中,观察溶液颜色的变化 | 能证明SO2具有漂白性 |
| C | 向2mL1mol•L-1NaOH溶液中先加入0.2mL1mol•L-1FeCl3溶液,再加入0.2mL1mol•L-1MgCl2溶液 | 证明Ksp[Mg(OH)2]>Ksp[Fe(OH)3] |
| D | 向2mL品红溶液和2mL加入少许醋酸的品红溶液中分别滴入3滴“84”消毒液,观察红色褪色的快慢 | 证明溶液pH的减少,“84”消毒液的氧化能力增强 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 纳米铁粉可以高效地去除被污染水体中的 Pb2+、Cu2+、Cd2+、Hg2+等重金属离子,其本质是纳米铁粉对重金属离子有较强的物理吸附 | |
| B. | 凡含有添加剂的食物对人体健康均有害,不宜食用 | |
| C. | 煤经过气化和液化等物理变化可以转化为清洁燃料 | |
| D. | 火力发电中,燃烧是使化学能转换为电能的关键 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:推断题
 .
.查看答案和解析>>
科目: 来源: 题型:解答题
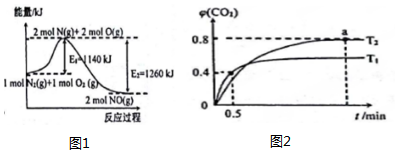
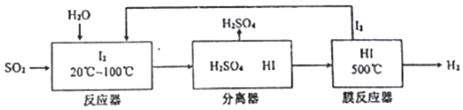
查看答案和解析>>
科目: 来源: 题型:实验题
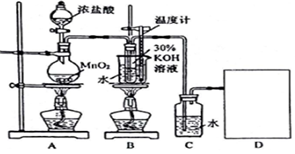
| 实验 编号 | 试剂及其用量 | |||
| 0.2mol•L-1kJ/mL | KClO3(s)/g | 6.0mol•L-1H2SO4/mL | H2O/mL | |
| 1 | 1.0 | 0.1 | 0 | a |
| 2 | 1.0 | 0.1 | 3.0 | b |
| 3 | 1.0 | 0.1 | 6.0 | c |
| 4 | 1.0 | 0.1 | 9.0 | 0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com