
科目: 来源: 题型:选择题
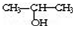 与NaOH的醇溶液共热制备CH3-CH═CH2
与NaOH的醇溶液共热制备CH3-CH═CH2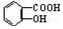 与适量NaHCO3溶液反应制备
与适量NaHCO3溶液反应制备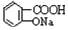
| A. | 只有③④ | B. | 只有①④ | C. | 只有① | D. | 都不能 |
查看答案和解析>>
科目: 来源: 题型:解答题
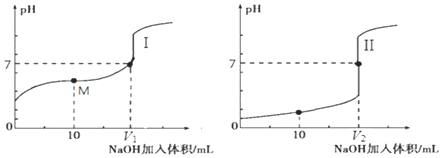
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 和4He是同一种原子 | B. | 比4He少一个质子 | ||
| C. | 是4He的同位素 | D. | 比4He多一个中子 |
查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:实验题
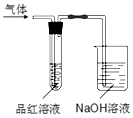 用如图所示的实验装置,比较SO2和Cl2的漂白性.请回答下列问题:
用如图所示的实验装置,比较SO2和Cl2的漂白性.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
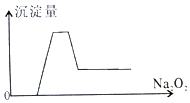 有一透明溶液,取出少量滴入BaCl2溶液,有白色沉淀生成;另取一定体积的该溶液加入过量Na2O2,有无色有刺激性味气体产生,同时有白色沉淀生成,其沉淀量(纵坐标)与加入Na2O2的量(横坐标)的关系如图所示,根据以上判断在该溶液中一定存在的离子是( )
有一透明溶液,取出少量滴入BaCl2溶液,有白色沉淀生成;另取一定体积的该溶液加入过量Na2O2,有无色有刺激性味气体产生,同时有白色沉淀生成,其沉淀量(纵坐标)与加入Na2O2的量(横坐标)的关系如图所示,根据以上判断在该溶液中一定存在的离子是( )| A. | ①②③④⑦ | B. | ①③④⑦ | C. | ①②③⑤⑦ | D. | ①③④⑧ |
查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com